Ortofosforskābe
| Ortofosforskābe | |
|---|---|
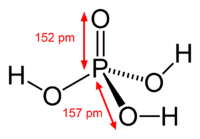 Ortofosforskābes struktūrformula ar starpatomu attālumiem  Ortofosforskābes molekulas modelis | |
| Citi nosaukumi | ūdeņraža oksofosfāts(V) |
| CAS numurs | 7664-38-2 |
| Ķīmiskā formula | H3PO4 |
| Molmasa | 98 g/mol |
| Blīvums | 1900 kg/m3 |
| Kušanas temperatūra | 42 °C |
| Viršanas temperatūra | 158 °C (sadalās) |
| Šķīdība ūdenī | 548 g/100 ml |
Ortofosforskābe (H3PO4) pieder pie fosfora(V) savienojumiem - fosforskābēm un ir vispazīstamākā no tām. Bieži to sauc vienkārši par fosforskābi.
Bezūdens ortofosforskābe ir bezkrāsaina cieta viela. Tā ir vidēji stipra, trīsvērtīga skābe. Tās sāļus sauc par fosfātiem. Atkarībā no tā, cik ūdeņraža atomi ir aizvietoti, var būt normālie fosfāti (PO43− atvasinājumi), hidrogēnfosfāti (HPO42− atvasinājumi) un dihidrogēnfosfāti (H2PO4− atvasinājumi).
Ortofosforskābes molekulai ir neregulāra tetraedra veids un tā veido daudz ūdeņraža saišu. Tādēļ koncentrēti ortofosforskābes šķīdumi ir ļoti viskozi.
Iegūšana[labot šo sadaļu | labot pirmkodu]
Ortofosforskābi iegūst, reaģējot tās anhidrīdam, fosfora pentoksīdam P4O10 ar ūdeni. Fosfora pentoksīdu parasti iegūst, sadedzinot fosforu. Šādā veidā iegūst tīru un koncentrētu skābi. Vēl fosforskābi var iegūt, tās sāļiem - fosfātiem - reaģējot ar sērskābi. Šādā veidā iegūst netīru un atšķaidītu skābi, taču tā ir lētāka. Mūsdienās fosforskābi šādā veidā ražo maz, jo lai arī lētāka, tā ir pārāk netīra.
Izmantošana[labot šo sadaļu | labot pirmkodu]
Fosforskābi plaši lieto par fosfora minerālmēslu izejvielu, mazgāšanas līdzekļiem, par pārtikas piedevu (E338) un juvelieri mēdz ar to tīrīt zeltu.
Literatūra[labot šo sadaļu | labot pirmkodu]
- N. Ahmetovs. Neorganiskā ķīmija. R:, Zvaigzne, 1978, 395. lpp.
Skatīt arī[labot šo sadaļu | labot pirmkodu]
Ārējās saites[labot šo sadaļu | labot pirmkodu]
 Vikikrātuvē par šo tēmu ir pieejami multivides faili. Skatīt: Ortofosforskābe.
Vikikrātuvē par šo tēmu ir pieejami multivides faili. Skatīt: Ortofosforskābe.
- Encyclopædia Britannica raksts (angliski)
- Brockhaus Enzyklopädie raksts (vāciski)
|
