Imatinibs
| Imatinibs | |
|---|---|
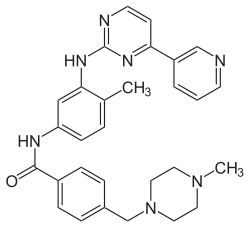 Imatiniba struktūrformula  Imatiniba molekulas datormodelis | |
| Citi nosaukumi | 4-[(4-metilpiperazīn-1-il)metil]-N-{4-metil-3-[(4-(piridīn-3-il)pirimidīn-2-il)amino]fenil}benzamīds |
| CAS numurs | 152459-95-5 |
| Ķīmiskā formula | C29H31N7O |
| Molmasa | 493,603 g/mol |
Imatinibs (starptautiskais nepatentētais nosaukums) jeb gliveks[1] ir tirozīnkināžu inhibitors, kuru izmanto noteiktu veidu ļaundabīgu saslimšanu ārstēšanā, it īpaši Filadelfijas hromosomas pozitīvās (Ph+) hroniskās mieloleikozes (HML) gadījumos.[2] Imatiniba oriģinators ir Novartis, un oriģinālais Imatinibs ir Eiropā pieejams ar preču zīmi Glivec.
Lai organisma šūnas varētu izdzīvot, tām ir nepieciešams saņemt signālus no citām šūnām ar olbaltumvielu pārnesto signālu kaskādes starpniecību. Daži no šīs kaskādes signāliem tiek ieslēgti, kad signālu nesošajai olbaltumvielai īpaši fermenti (tirozīnkināzes) pievieno fosfāta grupu (notiek olbaltumvielu fosforilēšana). Normālās šūnās tirozīnkināžu aktivitāte tiek precīzi regulēta atbilstoši organisma vajadzībām. Taču Ph+ HML gadījumā viena no tirozīnkināzēm (BCR-Abl) ģenētiskas mutācijas rezultātā ir pārmērīgi aktivizēta un nepārtraukti fosforilē signālus nesošās olbaltumvielas. Imatinibs specifiski bloķē šo kļūdaino tirozīnkināzi un novērš olbaltumvielu pārmērīgo fosforilēšanu. Tā rezultātā mutāciju nesošo audzēja šūnu dalīšanās tiek nomākta un tās iet bojā apoptozes procesā.[3]
Tā kā BCR-Abl tirozīnkināze veidojas tikai mutācijas rezultātā audzēja šūnās, un veselajās šūnās tās nav, tad imatinibs iedarbojas ļoti specifiski - tikai uz audzēja šūnām, kurās ir anomālā Filadelfijas hromosoma.[4] Imatinibs ir viens no pirmajiem šādu, mērķtiecīgi konstruētu, specifisku pretvēža zāļu molekulu piemēriem, un to min kā paraugu tālākajiem pētījumiem ļaundabīgo slimību ārstēšanā.[5]
Lielā mērā pateicoties tieši imatiniba un tam radniecīgu zāļu izgudrošanai, HML pacientu izredzes nodzīvot vairāk kā piecus gadus no diagnozes uzstādīšanas ir palielinājušās no 31% (1993. gadā, pirms imatiniba ieviešanas klīniskajā praksē 2001. gadā) līdz 59% (pacientiem, kuriem diagnoze uzstādīta no 2003. līdz 2009. gadam).[6] Salīdzinot ar agrāk izgudrotajām zālēm, imatiniba blakusefekti parasti nav smagi, un vairumam pacientu ir pieņemama dzīves kvalitāte.[7] Gastrointestinālo stromālo audzēju gadījumā pacientiem, kuri lieto imatinibu, vidējā dzīvildze sasniedz gandrīz 5 gadus, salīdzinot ar 9-20 mēnešiem bez imatiniba.[8]
Imatiniba oriģinators Novartis ir kritizēts par šo zāļu augsto cenu substances patenta darbības periodā (1993-2013), taču līdz ar šī pirmā patenta darbības beigām imatinibu tirgū piedāvā arī citi ražotāji. Latvijas Valsts Zāļu Aģentūrā 2015. gada februārī ir reģistrētas 19 dažādu ražotāju Imatiniba tabletes un kapsulas.[9] Imatiniba dažādus sāļus, kristālus, gatavās zāļu formas un tehnoloģijas aizsargā vēl citi patenti. Indijā šādi papildu patenti ir noraidīti, dodot Indijas ražotājiem un pacientiem lielas un joprojām apstrīdētas priekšrocības.[10]
Izmantošana medicīnā[labot šo sadaļu | labot pirmkodu]
Ar imatinibu ārstē hronisko mieloleikozi (HML), gastrointestinālos stromālos audzējus un dažas citas ļaundabīgās saslimšanas.
Hroniskā mieloleikoze[labot šo sadaļu | labot pirmkodu]
ASV Pārtikas un zāļu aģentūra (FDA) 2001. gadā apstiprināja imatinibu kā pirmās rindas zāles Filadelfijas hromosomas pozitīvos HML gadījumos pieaugušajiem un bērniem, tajā skaitā situācijās pēc cilmes šūnu transplantācijas, blastu krīzes gadījumā, kā arī nesen diagnosticētiem pacientiem.[11]
Gastrointestinālie stromālie audzēji[labot šo sadaļu | labot pirmkodu]
FDA 2002. gadā apstiprināja imatiniba lietošanu vēlīno stadiju gastrointestinālo stromālo audzēju gadījumos. Vēlāk, 2012. gadā imatinibu apstiprināja lietošanai pēc KIT-pozitīvu audzēju izoperēšanas, lai palīdzētu novērst recidīvus.[12] Šīs zāles ir apstiprinātas lietošanai arī neoperējamu KIT-pozitīvu gastrointestinālo stromālo audzēju gadījumos.[11]
Citas indikācijas[labot šo sadaļu | labot pirmkodu]
FDA atļauj imatinibu lietot pieaugušajiem ar relapsējušu vai rezistentu Filadelfijas hromosomas pozitīvo akūto limfoblastisko leikozi (Ph+ ALL), ar trombocītu augšanas faktora receptora gēnu pārgrupēšanos saistītām mielodisplastiskām/mieloproliferācijas slimībām, agresīvu sistēmisku mastocitozi bez / ar nezināmu D816V c-KIT mutāciju, hipereozinofilo sindromu (HES) un / vai hronisku eozinofilo leikozi (HEL), kam ir FIP1L1-PDGFRα hibrīdā kināze (CHIC2 alleles delēcija) vai FIP1L1-PDGFRα hibrīdās kināzes negatīva, vai nezināma, neoperējama, recidivējoša un/vai metastazējoša dermatofibrosarcoma protuberans.[13] Savukārt 2013. gada 25. janvārī imatinibu apstiprināja lietošanai bērniem ar Ph+ ALL.[14] Imatiniba spēja bloķēt c-KIT tirozīnkināzi ir devusi cerību, ka ar imatinibu varētu ārstēt progresējošu pleksiformo neirofibromu, kura ir saistīta ar I tipa neirofibromatozi.[15][16][17][18]
Atsauces[labot šo sadaļu | labot pirmkodu]
- ↑ Indulis Purviņš, Santa Purviņa. Praktiskā farmakoloģija. R:, Zāļu infocentrs, 2011, 349. lpp. ISBN 978-9984-854-20-5
- ↑ Novartis Pharma AG. Gleevec® (imatinib mesylate) tablets prescribing information. East Hanover, NJ; 2006 Sep. Anon. Drugs of choice for cancer. Treat Guidel Med Lett. 2003; 1:41–52
- ↑ Goldman JM, Melo JV (October 2003). "Chronic myeloid leukemia – advances in biology and new approaches to treatment". N. Engl. J. Med. 349 (15): 1451–64.
- ↑ Fausel, C. Targeted chronic myeloid leukemia therapy: Seeking a cure. Am J Health Syst Pharm 64, S9-15 (2007).
- ↑ Stegmeier F, Warmuth M, Sellers WR, Dorsch M (May 2010). "Targeted cancer therapies in the twenty-first century: lessons from imatinib". Clin. Pharmacol. Ther. 87 (5): 543–52.
- ↑ «Leukemia - Chronic Myeloid - CML: Statistics». Teksts " Cancer.Net" ignorēts
- ↑ «leukaemialymphomaresearch.org.uk». Arhivēts no oriģināla, laiks: 2014. gada 28. martā. Skatīts: 2015. gada 5. janvārī.
- ↑ De Giorgi U, Verweij J (March 2005). "Imatinib and gastrointestinal stromal tumors: Where do we go from here?". Mol. Cancer Ther. 4 (3): 495–501.
- ↑ «Latvijas Zāļu Valsts Aģentūras informācija par reģistrētiem imatiniba ražotājiem».[novecojusi saite]
- ↑ «Novartis fails to patent Glivec (Gleevec) in India».[novecojusi saite]
- ↑ 11,0 11,1 «FDA Highlights and Prescribing Information for Gleevec(imatinib mesylate)».
- ↑ «Prolonged Use of Imatinib in GIST Patients Leads to New FDA Approval». Arhivēts no oriģināla, laiks: 2012. gada 4. februārī. Skatīts: 2015. gada 20. februārī.
- ↑ http://www.accessdata.fda.gov/drugsatfda_docs/label/2008/021588s024lbl.pdf
- ↑ «FDA approves Gleevec for children with acute lymphoblastic leukemia». FDA News Release. US Food and Drug Administration. 2013. gada 25. janvāris. Arhivēts no oriģināla, laiks: 2013. gada 10. martā. Skatīts: 2013. gada 3. aprīlis.
- ↑ Yang FC, Ingram DA, Chen S, Zhu Y, Yuan J, Li X, Yang X, Knowles S, Horn W, Li Y, Zhang S, Yang Y, Vakili ST, Yu M, Burns D, Robertson K, Hutchins G, Parada LF, Clapp DW (October 2008). "Nf1-dependent tumors require a microenvironment containing Nf1+/--and c-kit-dependent bone marrow". Cell 135 (3): 437–48. doi:10.1016/j.cell.2008.08.041. PMC 2788814. PMID 18984156. Kopsavilkums – Science Daily.
- ↑ «Gleevec NF1 Trial». Nfcure.org. Arhivēts no oriģināla, laiks: 2012-04-20. Skatīts: 2013-04-03.
- ↑ «GIST in Neurofibromatosis 1». Gistsupport.org. 2010-05-14. Arhivēts no oriģināla, laiks: 2013-03-29. Skatīts: 2013-04-03.
- ↑ «"Pilot Study of Gleevec/Imatinib Mesylate (STI-571, NSC 716051) in Neurofibromatosis (NF1) Patient With Plexiform Neurofibromas (0908-09)" (Suspended)». Clinicaltrials.gov. Skatīts: 2013-04-03.
| Šis ar farmakoloģiju saistītais raksts ir nepilnīgs. Jūs varat dot savu ieguldījumu Vikipēdijā, papildinot to. |
