Karbamīds
| Karbamīds | |
|---|---|
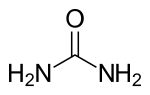  Karbamīda struktūrformula un molekulas modelis | |
| Ķīmiskā formula | (NH2)2CO |
| Molmasa | 60,07 g/mol |
| Blīvums | 1330 kg/m3 |
| Kušanas temperatūra | 132,7 °C (sadalās) |
| Viršanas temperatūra | - |
Karbamīds (urīnviela, (NH2)2CO) ir ogļskābes amīds. Tā ir pirmā organiskā viela, kas tika sintezēta no neorganiskām izejvielām. Tas ir balta, ūdenī šķīstoša viela. Lielāko daļu saražotā karbamīda lieto par minerālmēslojumu.
Karbamīdu ražo no amonjaka un oglekļa dioksīda, tas ir divu stadiju process:
1. 2NH3 + CO2 → H2N−COONH4
2. H2N-COONH4 → (NH2)2CO + H2O
Ražojot amonjaka sintēzei nepieciešamo ūdeņradi, rodas liels daudzums oglekļa dioksīda, kuru var lietot par karbamīda izejvielu. Karbamīds veidojas arī abinieku un zīdītāju organismā, kā olbaltumvielu sadalīšanās galaprodukts un no organisma izdalās ar urīnu. Putniem un rāpuļiem olbaltumvielu sadalīšanās produkts ir urīnskābe.
Vairāk nekā 90% pasaulē saražotā karbamīda lieto kā minerālmēslojumu, jo tam ir vislielākais slāpekļa īpatsvars. Karbamīdam reaģējot ar formaldehīdu, veidojas karbamīdformaldehīda sveķi, kurus dažreiz lieto plastmasām.
Karbamīdi ir organisko savienojumu klase, kur karbamīda molekulas aminogrupās viens vai vairāki ūdeņraža atomi ir aizvietoti ar organisku radikāli. Tos iegūst, fosgēnam reaģējot ar attiecīgajiem amīniem.
COCl2 + NH2R → (RNH)2CO + 2HCl
Karbamīda šķīdums ūdenī (32,5%) tiek izmantots dīzeļdzinēju izplūdes gāzēs esošo slāpekļa oksīdu neitralizēšanai. Šo šķīdumu sauc arī par DEF (Diesel Exhaust Fluid), un tas ir pazīstams kā Vācijas Automobiļu Industrijas asociācijas (VDA) reģistrēts zīmols AdBlue, kuru šobrīd iespējams iegādāties noteiktās degvielas uzpildes stacijās.
| Šis ar ķīmiju saistītais raksts ir nepilnīgs. Jūs varat dot savu ieguldījumu Vikipēdijā, papildinot to. |
|
