Prizmāns
| Prizmāns | |
|---|---|
  Prizmāna struktūrformulas  Prizmāna molekulas modelis | |
| Citi nosaukumi |
tetraciklo[2.2.0.02,6.03,5]heksāns, Ladenburga benzols |
| CAS numurs | 650-42-0 |
| Ķīmiskā formula | C6H6 |
| Molmasa | 78,1 g/mol |
Prizmāns jeb Ladenburga benzols (C6H6) ir viens no eksotiskajiem benzola izomēriem. Tas ir piesātināts tetraciklisks ogļūdeņradis — tetracikloheksāns, kura molekulai ir trijstūra prizmas forma, kas atspoguļota vielas pieņemtajā triviālajā nosaukumā. Prizmāns ir bezkrāsains, eksplozīvs šķidrums.
Vēsture
[labot šo sadaļu | labot pirmkodu]Benzola struktūrformulu, kurā benzola molekula tika attēlota trijstūra prizmas veidā, ieteica vācu ķīmiķis Alberts Ladenburgs 1869. gadā. Par labu šim molekulas modelim runāja visu sešu benzola oglekļa atomu līdzvērtīgums un triju izomēru (orto-, meta- un para-) iespēja divaizvietotajiem benzola atvasinājumiem.

Tomēr 1876. gadā Jakobs van't Hofs norādīja, ka prizmveida struktūras benzolam ar diviem dažādiem aizvietotājiem orto- un meta- izomēriem jābūt novērojamai optiskās izomērijas parādībai, bet praksē nekas tāds netika novērots.
Kaut arī Ladenburga ieteiktā formula izrādījās pilnīgi nepareiza, 1973. gadā mākslīgi tika sintezēts (Tomass Kacs un Nensija Ektone, Kolumbijas Universitāte) ogļūdeņradis ar šādu molekulas uzbūvi.[1] Pirms tam, 1966. gadā, tika iegūts prizmāna atvasinājums heksametilprizmāns (tā molekulā visi prizmāna ūdeņraža atomi aizvietoti ar metilgrupām); šis savienojums ir daudz stabilāks par pašu prizmānu.[2]
Iegūšana
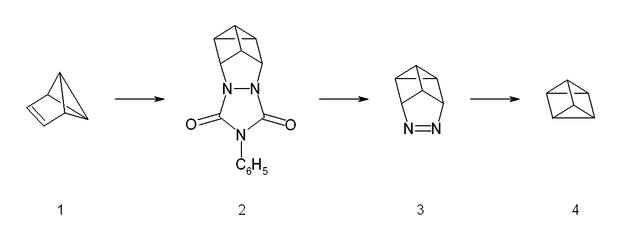
[labot šo sadaļu | labot pirmkodu]Prizmāna sintēze ir ļoti grūta, jo tā ķīmiskās saites zemās aktivācijas enerģijas dēļ viegli sabrūk rašanās brīdī. Prizmānu iegūst no cita benzola izomēra — benzvalēna (1), tam iesaistoties Dīlsa—Aldera reakcijai līdzīgā reakcijā ar 4-feniltriazolidonu. Radušos aduktu (2) pēc tam hidrolizē bāziskos apstākļos un pārveido par vara(II) hlorīda atvasinājumu ar paskābinātu vara(II) hlorīdu. Neitralizējot ar stipru bāzi, izveidojušos azosavienojumu (3) var kristalizēt ar 65% iznākumu. Sintēzes pēdējā fāzē azosavienojumu pakļauj fotolīzei, kas to sadala par prizmānu (4) un slāpekli (reakcijas iznākums zem 10%). Tīrā veidā prizmānu izolē ar preparatīvās gāzu hromatogrāfijas palīdzību.
Īpašības
[labot šo sadaļu | labot pirmkodu]Prizmāna molekula tās saspriegto ķīmisko saišu dēļ (tās ir vēl vairāk saspriegtas, nekā ciklopropānam) satur daudz vairāk enerģijas nekā benzola molekula, tomēr istabas temperatūrā prizmāns ir stabils (pareizāk, metastabils), kaut arī ļoti sprādziennedrošs (eksplozivitāte ir pavisam neraksturīga ogļūdeņražiem). Lai arī prizmāna pārgrupēšanās par benzolu ir enerģētiski ļoti izdevīga, to kavē tā saucamais Vudvorda—Hofmana likums, kas neļauj molekulāro orbitāļu simetrijas izjaukšanu. 1969. gadā Vudvords un Hofmans šo parādību salīdzināja ar nikna tīģera nespēju izkļūt no papīra būra.[3]
Atsauces
[labot šo sadaļu | labot pirmkodu]| Vikikrātuvē par šo tēmu ir pieejami multivides faili. Skatīt: Prizmāns |
- ↑ Katz T. J., Acton N. (1973). "Synthesis of Prismane". Journal of the American Chemical Society 95 (8): 2738–2739. doi:10.1021/ja00789a084.
- ↑ Lemal D. M., Lokensgard J. P. (1966). "Hexamethylprismane". Journal of the American Chemical Society 88 (24): pp 5934–5935. doi:10.1021/ja00976a046.
- ↑ R. B. Woodward and R. Hoffmann, Angew. Chem., Int. Ed. Engl., 8, 789, (1969)