Amonija nitrīts
| Amonija nitrīts | |
|---|---|
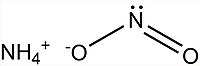 Amonija nitrīta formulvienības struktūrformula  Amonija nitrīta formulvienības modelis | |
| CAS numurs | 13446-48-5 |
| Ķīmiskā formula | NH4NO2 |
| Molmasa | 68,03 g/mol |
| Blīvums | 1690 kg/m3 |
| Kušanas temperatūra | sadalās |
| Šķīdība ūdenī | 118,3 g / 100 ml |
Amonija nitrīts (NH4NO2) ir slāpekļpaskābes amonija sāls. Tā ir kristāliska bezkrāsaina viela (smalki prizmveida kristāli, uzglabājot kļūst dzeltenīgi). Amonija nitrīts glabājot pamazām sadalās, it sevišķi paaugstinātā temperatūrā. Sadaloties izdalās slāpeklis, tādēļ amonija nitrītu nedrīkst uzglabāt hermētiski noslēgtos traukos, jo, pieaugot spiedienam, pēc kāda laika var notikt eksplozija. Karsējot sausu amonija nitrītu, jau pie 60—70 °C notiek spēcīgs sprādziens. Amonija nitrīts viegli eksplodē arī trieciena iedarbībā, vai beržot piestā. Labi šķīst ūdenī, metanolā un etanolā, slikti šķīst ēterī. Koncentrētos ūdens šķīdumos amonija nitrīts ātri sadalās, it sevišķi temperatūrā virs 33 °C. Amonija nitrīts ir samērā toksiska viela.
Iegūšana[labot šo sadaļu | labot pirmkodu]
Lai laboratorijā iegūtu amonija nitrīta ūdens šķīdumu, sajauc siltus amonija perhlorāta un kālija nitrīta šķīdumus:
- NH4ClO4 + KNO2 → KClO4 + NH4NO2
Maisījumu ātri atdzesē ar aukstu ūdeni un atstāj uz diennakti, pēc tam nolej iegūto NH4NO2 šķīdumu no kālija perhlorāta nogulsnēm. Šķīdumu uzglabā tumšā un vēsā vietā.[1]
Iegūšanā iespējams izmantot arī citas apmaiņas reakcijas, piemēram, bārija vai svina nitrīta reakciju ar amonija sulfātu, vai sudraba nitrīta reakciju ar amonija hlorīdu.
Var iegūt arī, reducējot amonija nitrātu ar ūdeņradi izdalīšanās brīdī paskābinātā šķīdumā:
- NH4NO3 + 2H → NH4NO2 + H2O
Amonija nitrīts rodas, laižot cauri amonjaka ūdens šķīdumam NO un NO2 maisījumu[2]:
- 2NH3·H2O + NO + NO2 → 2NH4NO2 + H2O
NH4NO2 iespējams iegūt, oksidējot amonjaku ar ozonu vai ūdeņraža peroksīdu.
Ķīmiskās īpašības[labot šo sadaļu | labot pirmkodu]
Amonija nitrīts ir stipri eksplozīva viela! |
NH4NO2 viegli sadalās par slāpekli un ūdeni:
- NH4NO2 → N2 + 2H2O
Šo reakciju var izmantot, lai laboratorijas apstākļos iegūtu tīru slāpekli.
Tā kā amonija nitrīts ir vājas skābes un vājas bāzes sāls, tas viegli sadalās skābā vai sārmainā vidē:
Spēj oksidēties ar gaisa skābekli:
- 2NH4NO2 + O2 → 2NH4NO3
Izmantošana[labot šo sadaļu | labot pirmkodu]
Amonija nitrītu izmanto par dezinfekcijas līdzekli, rodenticīdu, kā arī lauksaimniecībā par pesticīdu. Lieto hidroksilamīna un tā sāļu sintēzēm.
Atsauces[labot šo sadaļu | labot pirmkodu]
| Vikikrātuvē par šo tēmu ir pieejami multivides faili. Skatīt: amonija nitrīts |
- ↑ Карякин Ю. В., Ангелов И. И. Чистые химические вещества. Москва : Химия, 1974, 33. lpp. (krieviski)
- ↑ Thomas Scott, Mary Eagleson. Concise encyclopedia chemistry. Walter de Gruyter, 1994. 66. lpp. ISBN 3-11-011451-8.
