Magnija fosfāts
Izskats
| Magnija fosfāts | |
|---|---|
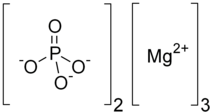 Magnija fosfāta struktūrformula  Magnija fosfāta paraugs | |
| CAS numurs | 7757-87-1 |
| Ķīmiskā formula | Mg3(PO4)2 |
| Kušanas temperatūra | 1184 °C |
| Viršanas temperatūra | — |
| Šķīdība ūdenī | nešķīst |
Magnija fosfāts ir magnija un fosforskābes neitrālais sāls ar formulu Mg3(PO4)2. Tas ūdens šķīdumos veido kristālhidrātus ar formulu Mg3(PO4)2·xH2O. Kristālhidrāti var saturēt dažādu ūdens daudzumu (x = 0, 5, 8, 22).[1]
Oktahidrāts rodas, magnija dihidrogēnfosfāta tetrahidrātam reaģējot ar magnija hidroksīdu stehiometriskās attiecībās:
- Mg(H2PO4)2·4H2O + 2Mg(OH)2 → Mg3(PO4)2·8H2O
Oktahidrāts dabā ir sastopams kā minerāls bobierīts.[2]
Bezūdens formu iegūst, karsējot hidrātus 400 °C temperatūrā. Bezūdens magnija fosfātam ir tāda pati struktūra kā kobalta(II) fosfātam. Metāla joni aizņem gan oktaedriskas (sešu koordinātu), gan pentakoordinātu vietas attiecībā 1:2.[3]
Drošība
[labot šo sadaļu | labot pirmkodu]Magnija fosfāts ir atzīts par drošu jeb iekļauts GRAS vielu sarakstā.[4] To izmanto kā pārtikas piedevu E343.
Atsauces
[labot šo sadaļu | labot pirmkodu]- ↑ Klaus Schrödter, Gerhard Bettermann, Thomas Staffel, Friedrich Wahl, Thomas Klein, Thomas Hofmann. «Phosphoric Acid and Phosphates». Ullmann's Encyclopedia of Industrial Chemistry. Weinheim : Wiley-VCH, 2008. ISBN 978-3527306732. doi:10.1002/14356007.a19_465.pub3.
- ↑ «magnesium phosphate - Compound Summary». Skatīts: 2012. gada 29. maijs.
- ↑ Nord, A. G.; Stefanidis, T. (1983). "Structure of cobalt(II) phosphate Structure Refinements of Co3(PO4)2. A Note on the Reliability of Powder Diffraction Studies". Acta Chemica Scandinavica A 37: 715–p721. doi:10.3891/acta.chem.scand.37a-0715.
- ↑ «TRIMAGNESIUM PHOSPHATE». Skatīts: 2012. gada 29. maijs.
| ||||||
