Aktivācijas enerģija
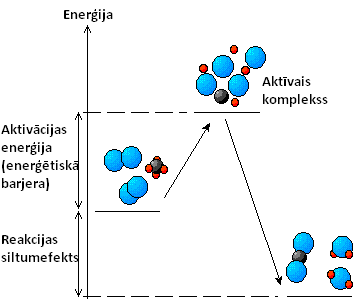
Aktivācijas enerģija (parasti apzīmē ar Ea) ir minimālā enerģija, kas nepieciešama vielu molekulām, lai notiktu ķīmiskā reakcija. Aktivācijas enerģijas jēdzienu ieviesis zviedru fizikālķīmiķis Svante Arrēniuss 1889. gadā.
Lai ķīmiskā reakcija varētu norisināties, reaģējošo vielu molekulām ir savā starpā jāsaduras, tomēr tas nav pietiekams nosacījums, jo molekulu elektronu apvalki savā starpā atgrūžas. Tādēļ molekulām jābūt pietiekamai enerģijai (tām jākustas pietiekami ātri), lai atgrūšanos varētu pārvarēt un satuvināt molekulas tik tuvu, ka sāktos elektronu sadalījuma pārgrupēšanās un jaunu ķīmisko saišu veidošanās. Šo nepieciešamo enerģijas daudzumu sauc arī par enerģētisko barjeru, bet daļiņas (molekulas), kam piemīt tāda enerģija, kas ļauj pārvarēt enerģētisko barjeru — par aktīvām daļiņām. Reakcijas produktu kopējais enerģijas līmenis parasti ir atšķirīgs no izejvielu enerģijas un to sauc par reakcijas siltumefektu. Eksotermiskām reakcijām (tādām reakcijām, kuru norises gaitā izdalās papildus enerģija) siltumefekts ir pozitīvs.
Arī aktivācijas enerģijas sasniegšana nav pietiekams nosacījums, lai reakcija notiktu — molekulām turklāt jābūt orientētām tā, lai elektronu blīvuma pārkārtošanās būtu telpiski iespējama (sk. aktivācijas entropija).
Pateicoties aktivācijas enerģijai, visas enerģētiski iespējamās reakcijas nenorisinās uzreiz, bet tikai piemērotos apstākļos. Piemēram, sērkociņa izdevīgākais stāvoklis ir sadegšana, tomēr neaizdedzināts sērkociņš gaisa klātbūtnē var atrasties neierobežoti ilgi. Degšanas reakcija sākas tikai tad, kad sērkociņam pievada pietiekamu enerģiju — beržot to pret sērkociņu kastītes abrazīvo sānu.
Aktīvais komplekss
[labot šo sadaļu | labot pirmkodu]Kad enerģētiskā barjera ir pārvarēta, uz ļoti īsu brīdi (apmēram 10-15 s) veidojas sevišķs molekulu grupējums (aktīvais komplekss), kurā notiek saišu pārkārtošanās process. Aktīvajam kompleksam sabrūkot, rodas reakcijas produkti (vai arī no jauna reakcijas izejvielas). Tādējādi aktivācijas enerģiju var definēt arī kā aktīvā kompleksa izveidošanai nepieciešamo enerģiju. Lai arī šī enerģija dažreiz mēdz būt visai liela, tomēr tā ir mazāka, nekā pilnīgai izejvielu molekulu saišu saraušanai nepieciešamā enerģija, tādēļ gandrīz visas reakcijas notiek, veidojoties šādiem kompleksiem.
Katalīze
[labot šo sadaļu | labot pirmkodu]Katalīze ir ķīmisko reakciju paātrināšanas metode, pazeminot reakcijas aktivācijas enerģiju. Tas iespējams, pievienojot reaģējošām vielām kādu citu vielu — katalizatoru, kurš veido starpsavienojumus, kas prasa mazāku aktivācijas enerģiju. Piemēram, ja dotas vielas A un B, kuras var veidot enerģētiski izdevīgu savienojumu AB, tad atbilstošā aktīvā kompleksa A*B veidošanās enerģija var būt ļoti liela, tāpēc reakcija A + B → A*B → AB praktiski nenotiek. Var atrast trešo vielu K, kas reaģē ar vielu A, veidojot savienojumu AK, turklāt aktīvā kompleksa A*K rašanās enerģija ir maza un reakcija noris ātri:
- A + K → A*K → AK
Savukārt viela AK var viegli reaģēt ar vielu B, jo aktīvā kompleksa B*AK izveidošanai arī vajag maz enerģijas:
- B + AK → B*AK → AB + K
Tādējādi galarezultātā tiek iegūts savienojums AB, bet viela K (katalizators) nav patērējusies.
Matemātiskais apraksts
[labot šo sadaļu | labot pirmkodu]Reakcijas ātruma konstanti un absolūto temperatūru saista Arrēniusa vienādojums:
,
kur ir gāzu universālkonstante, — aktivācijas enerģija, — pirmseksponenciālā konstante.
Aktivācijas enerģiju aprēķina no 2 ātruma konstantēm (, temperatūrās un pēc šādas formulas:ln vai no koordinātās (ln, 1/) konstruētā grafika, bet, ja zināmo lielumu ir mazāk, tad to var aprēķināt arī pēc šādas formulas:
,
kur A ir pirmseksponenciālā konstante, R ir gāzu universālkonstante, T ir temperatūra kelvinos, un k ir reakcijas ātruma konstante.
Aktivācijas enerģija ir nemainīga tikai noteiktā temperatūras intervālā. Aktivācijas enerģija ir svarīgs ķīmiskās reakcijas kinētikas raksturlielums — jo tā mazāka, jo reakcija norisinās ātrāk.
Literatūra
[labot šo sadaļu | labot pirmkodu]| Vikikrātuvē par šo tēmu ir pieejami multivides faili. Skatīt: Aktivācijas enerģija |
- N. Ahmetovs. Neorganiskā ķīmija. R:, Zvaigzne, 1978, 200.—201. lpp.













