Kālija hlorāts
| Kālija hlorāts | |
|---|---|
 Kālija hlorāta struktūrformula  Kālija hlorāta kristālrežģis  Kālija hlorāta kristāli | |
| Citi nosaukumi | Bertolē sāls |
| CAS numurs | 3811-04-9 |
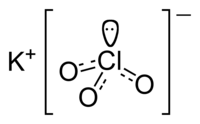
| Ķīmiskā formula | KClO3 |
| Molmasa | 122,55 g/mol |
| Blīvums | 2320 kg/m3 |
| Kušanas temperatūra | 356 °C |
| Viršanas temperatūra | ~400 °C (sadalās) |
| Šķīdība ūdenī |
7,19 g/100 ml (20 °C) |
Kālija hlorāts (Bertolē sāls, KClO3) ir hlorskābes kālija sāls. Bertolē sāls ir balta, kristāliska viela, kas šķīst ūdenī. Šķīdība stipri palielinās, paaugstinoties temperatūrai.
Vēsture
[labot šo sadaļu | labot pirmkodu]Pirmo reizi ieguvis Klods Bertolē 1786. gadā, tādēļ viela nosaukta viņa vārdā.
Iegūšana
[labot šo sadaļu | labot pirmkodu]Kālija hlorātu var iegūt pēc Bertolē metodes, reaģējot kālija hidroksīdam ar hloru. Parasti to realizē, ievadot siltā, koncentrētā kālija hidroksīda šķīdumā hloru. Kā blakusprodukts veidojas kālija hlorīds. Ja šķīdums būs auksts, pārsvarā veidosies kālija hipohlorīts. Kālija hlorātu var iegūt arī, sadalot šo hipohlorītu.
- 2KOH + Cl2 → KCl + KClO + H2O;
- 3KClO → KClO3 + 2KCl
Kālija hlorātu var iegūt arī aizvietošanas reakcijā no kālija hlorīda un nātrija hlorāta. Kālija hlorāts ir mazšķīstošāks, tāpēc izgulsnējas.
Īpašības
[labot šo sadaļu | labot pirmkodu]
No kālija hlorāta, elektrolītiski oksidējot, var iegūt kālija perhlorātu.
Karsējot kālija hlorāts sadalās, izdalot skābekli. Kā starpprodukts veidojas kālija perhlorāts.
- 4KClO3 → 3KClO4 + KCl
- KClO4 → KCl + 2O2↑
Kālija hlorāta maisījumi ar degtspējīgām vielām, piemēram, ogli, sēru, organiskām vielām, ir sprādzienbīstami! |
Izmantošana
[labot šo sadaļu | labot pirmkodu]Lieto pirotehniskos maisījumos par oksidētāju. Agrāk izmantoja kā sprāgstvielu (baltā šaujampulvera sastāvdaļu), bet mūsdienās kālija hlorātu saturošas sprāgstvielas neizmanto, jo tās ir pārāk nestabilas un bīstamas. Kālija hlorāts ietilpst sērkociņu galviņu degmateriāla sastāvā.
| Vikikrātuvē par šo tēmu ir pieejami multivides faili. Skatīt: Kālija hlorāts |
