Sērpaskābe
| Sērpaskābe | |
|---|---|
 Sērpaskābes struktūrformula 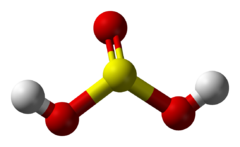 Sērpaskābes molekulas modelis  Ampula ar SO2 ūdens šķīdumu | |
| Citi nosaukumi |
ūdeņraža trioksosulfāts(IV), ūdeņraža sulfīts |
| CAS numurs | 7782-99-2 |
| Ķīmiskā formula | H2SO3 |
| Molmasa | 82,07 g/mol |
| Blīvums | — kg/m3 |
| Kušanas temperatūra | — |
| Viršanas temperatūra | — |
| Šķīdība ūdenī |
pastāv tikai atšķaidītos ūdens šķīdumos |
Sērpaskābe (H2SO3) ir sēru saturoša skābe, kas tīrā veidā nepastāv (tomēr konstatētas atsevišķas tās molekulas gāzes fāzē).[1] Ūdens šķīdumos sērpaskābe ir vidēji stipra (pirmā skābuma konstante 1,857) divvērtīga skābe, tai piemīt asa smaka neizreaģējušā SO2 dēļ. Sērpaskābes sāļus sauc par sulfītiem, bet skābos sāļus — par hidrogēnsulfītiem jeb bisulfītiem.
Atrašanās dabā
[labot šo sadaļu | labot pirmkodu]Sērpaskābe ir skābā lietus veidošanās starpprodukts no gaisā nonākušā sēra dioksīda.[2]
Iegūšana
[labot šo sadaļu | labot pirmkodu]Sērpaskābi iegūst, šķīdinot ūdenī sērpaskābes anhidrīdu jeb sēra dioksīdu SO2:
- SO2 + H2O ⇄ H2SO3 ⇄ H+ + HSO3− ⇄ 2H+ + SO32−
Īpašības
[labot šo sadaļu | labot pirmkodu]Ar Ramana spektroskopijas metodi konstatēts, ka sēra dioksīda ūdens šķīdumi satur tikai hidrogēnsulfītjonus HSO3− un neizreaģējušas SO2 molekulas.[3]
Ar skābekļa-17 kodolu magnētiskās rezonanses spektrometrijas metodi atrasts, ka hidrogēnsulfītjons ir divu izomēru maisījums. Vienam izomēram protons (ūdeņradis) pievienojies pie centrālā sēra atoma, bet otram — pie skābekļa atoma:[4]
- [H−OSO2]− ⇄ [H−SO3]−
Šādu apgriezenisku izomēriju sauc par tautomēriju. Ir iegūti abu hidrogēnsulfīta tautomēro formu atvasinājumi.
Sērpaskābes molekulā sērs ir četrvērtīgs un atrodas vidējā oksidēšanas pakāpē, tādēļ sērpaskābe var būt kā oksidētājs, tā reducētājs.
Izmantošana
[labot šo sadaļu | labot pirmkodu]Sēra dioksīdu vai sulfītus saturošus šķīdumus lieto par dezinfekcijas līdzekļiem un reducējošiem reaģentiem. Šādiem šķīdumiem ir balinošas īpašības un tie iedarbojas maigāk, nekā hloru saturoši balinātāji. Sērpaskābi lieto arī augļu konservēšanai.[5]
Atsauces
[labot šo sadaļu | labot pirmkodu]- ↑ D. Sülzle, M. Verhoeven, J. K. Terlouw, H. Schwarz (1988). "Generation and Characterization of Sulfurous Acid (H2SO3) and of Its Radical Cation as Stable Species in the Gas Phase". Angew. Chem. Int. Ed. Engl. 27 (11): 1533–4. doi:10.1002/anie.198815331.
- ↑ McQuarrie and Rock (1987), General Chemistry, 2nd ed., W.H. Freeman and Company, N.Y., p.243, ISBN 0-7167-1806-5
- ↑ Jolly, William L. (1991), Modern Inorganic Chemistry (2nd izd.), New York: McGraw-Hill, ISBN 0-07-032768-8
- ↑ Catherine E. Housecroft, Alan G. Sharpe. «Chapter 16: The group 16 elements». Inorganic Chemistry, 3rd Edition. Pearson, 2008. 520. lpp. ISBN 978-0-13-175553-6.
- ↑ N.Ahmetovs. Neorganiskā ķīmija, Rīga, "Zvaigzne", 1978, 335. lpp.
Ārējās saites
[labot šo sadaļu | labot pirmkodu] Vikikrātuvē par šo tēmu ir pieejami multivides faili. Skatīt: Sērpaskābe.
Vikikrātuvē par šo tēmu ir pieejami multivides faili. Skatīt: Sērpaskābe.
- Encyclopædia Britannica raksts (angliski)
|
