Sēra dioksīds
| Sēra dioksīds | |
|---|---|
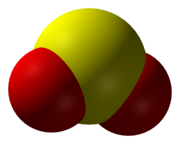 Sēra dioksīda molekulas modelis  Sēra dioksīda struktūrformula ar starpatomu attālumiem un leņķiem | |
| Citi nosaukumi |
sērpaskābes anhidrīds, sēra(IV) oksīds |
| CAS numurs | 7446-09-5 |
| Ķīmiskā formula | SO2 |
| Molmasa | 64 g/mol |
| Blīvums | 2,551 kg/m3 |
| Kušanas temperatūra | −72,4 °C (200,75 K) |
| Viršanas temperatūra | −10 °C (263 K) |
| Šķīdība ūdenī | 11,5 g/100 ml |
Sēra dioksīds (SO2) ir bezkrāsaina, korozīva, viegli sašķidrināma, indīga gāze. Tas ir skābais oksīds un, reaģējot ar ūdeni, veido sērpaskābi, bet, reaģējot ar bāziskajiem un amfotērajiem oksīdiem — sulfītus (sērpaskābes sāļus). Sēra dioksīds veidojas, sadegot sēram vai sērūdeņradim (arī sērorganiskajiem savienojumiem). Tā kā akmeņogles un naftas produkti bieži vien satur sēru vai tā savienojumus, to sadegšanas produkti arī bieži vien satur sēra dioksīdu. Dabā sēra dioksīds ir sastopams vulkānu gāzēs. Atmosfērā sēra dioksīds lēnām oksidējas par sēra trioksīdu, kas tālāk veido sērskābi, kas ir skābā lietus sastāvdaļa.
Iegūšana
[labot šo sadaļu | labot pirmkodu]Sēra dioksīdu var iegūt, dedzinot sēru, sērūdeņradi vai sērorganiskos savienojumus:
- S + O2 → SO2
- 2H2S + 2O2 → SO2 + 2H2O
- 2CH3CH2SH + 9O2 → 4CO2 + 2SO2 + 6H2O
Vēl sēra dioksīdu var iegūt, apdedzinot sulfīdu rūdas (sulfīdus):
- 2CuS + 3O2 → 2CuO + 2SO2
- 4FeS2 + 11O2 → 2Fe2O3 + 8SO2
Sēra dioksīds var veidoties cementa ražošanas procesā, ja kalcija izejviela ir kalcija sulfāts un izejvielu maisījumam ir pielikta ogle:
- 2CaSO4 + 2SiO2 + C → 2CaSiO3 + 2SO2 + CO2
Sēra dioksīds veidojas, termiski sadalot sulfātus. Šis ir divu stadiju process: vispirms sulfāts sadalās par metāla oksīdu un sēra trioksīdu, pēc tam sēra trioksīds sadalās par sēra dioksīdu un skābekli (sēra trioksīds sulfātu sadalīšanās temperatūrās (~1000 °C) ir nestabils):
- CaSO4 → CaO + SO3
Sēra dioksīds veidojas, koncentrētai sērskābei reaģējot ar varu:
- Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
Īpašības
[labot šo sadaļu | labot pirmkodu]Sēra dioksīds ir stipri toksiska gāze! |
Sēra dioksīds ir skābais oksīds, tas spēj oksidēties un spēj darboties kā ligands kompleksajos savienojumos.
Reaģējot ar sārmiem, sēra dioksīds veido sulfītus (sērpaskābes sāļus):
- SO2 + 2NaOH → Na2SO3 + H2O
Sēra dioksīds ir reducētājs, tas spēj reducēt halogēnus:
- SO2 + Cl2 → SO2Cl2
Atsevišķos gadījumos sēra dioksīds var būt arī oksidētājs:
- SO2 + 2H2S → 3S + 2H2O
Izmantošana
[labot šo sadaļu | labot pirmkodu]Lielākā daļa saražotā sēra dioksīda ir sērskābes ražošanas starpprodukts. Ievērojama daļa sēra dioksīda veidojas, dedzinot sēru saturošu kurināmo un nonāk gaisā, veidojot skābo lietu.
Sēra dioksīdu lieto par konservantu, lai samazinātu augļu pūšanu. To arī liek klāt vīnam, lai novērstu bojāšanos. Sēra dioksīdu dažreiz lieto arī pagrabu dezinficēšanai un citu dzīvo radību iznīcināšanai.
Sēra dioksīdu dažreiz lieto par balinātāju (papīram un audumiem). Tas darbojas kā reducētājs un noreducē izbalināmās krāsvielas uz reducētu, bezkrāsainu formu. Sēra dioksīds nesagrauj materiāla struktūru, taču balināšanas efekts ir pārejošs, jo gaisa skābeklis izbalinātās krāsvielas ar laiku nooksidē atpakaļ.
Tā kā sēra dioksīds ir relatīvi viegli sašķidrināms, to pirms freonu izgudrošanas lietoja par aukstumnesēju ledusskapjiem. Sašķidrinātu sēra dioksīdu lieto arī par šķīdinātāju.
| Vikikrātuvē par šo tēmu ir pieejami multivides faili. Skatīt: sēra dioksīds |
|
