Silīcija dioksīds
| Silīcija dioksīds | |
|---|---|
 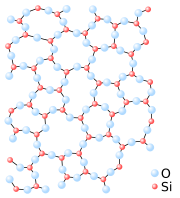 Kvarca kristāliskā struktūra un kvarca stikla amorfā struktūra  Balto smilšu kāpa, sastāvoša galvenokārt no SiO2 | |
| Citi nosaukumi |
silīcija(IV) oksīds silīcijskābes anhidrīds |
| CAS numurs | 7631-86-9 |
| Ķīmiskā formula | SiO2 |
| Molmasa | 60,1 g/mol |
| Blīvums | ~2600 kg/m3 |
| Kušanas temperatūra | 1650±75 °C |
| Viršanas temperatūra | 2230 °C |
| Šķīdība ūdenī |
normālos apstākļos praktiski nešķīst, bet pie 500 °C šķīdība sasniedz 0,25%[1] |
Silīcija dioksīds (SiO2) normālos apstākļos ir cieta kristāliska viela. Tas ir silīcijskābes anhidrīds. Dabā parasti silīcija dioksīds ir sastopams kristāliskā formā, kā kvarcs. Paaugstinātās temperatūrās var veidoties arī citas kristāliskās formas (tridimīts). Amorfā forma (kvarca stikls) ir kinētiski stabila. Silīcija dioksīds pieder pie polimēru tipa savienojumiem ar koordinatīvo režģi (dažādos veidos savienojušies SiO4 tetraedri), tāpēc tam raksturīga liela ķīmiskā stabilitāte un augsta kušanas temperatūra.
Tīrs, monokristālisks vai stiklveida silīcija dioksīds ir cieta, caurspīdīga viela ar labām elektroizolācijas īpašībām.
Īpašības
[labot šo sadaļu | labot pirmkodu]Silīcija dioksīds ir ķīmiski inerts un nereaģē ne ar tīru ūdeni, ne ar skābēm (izņemot fluorūdeņražskābi). Silīcija dioksīds var reaģēt ar sārmiem, veidojot silīcijskābes sāļus, taču parasti istabas temperatūrā šīs reakcijas ir ļoti lēnas. Silīcija dioksīds ir silīcija un visu silīcija savienojumu izejviela.
Plāna silīcija dioksīda kārtiņa veidojas uz silīcija virsmas. Paaugstinātā temperatūrā tā var kļūt biezāka.
| Forma | Kristālu tips | Uzbūves īpatnības | Piezīmes |
|---|---|---|---|
| α-kvarcs | romboedrisks (trigonāls) | struktūrā var izšķirt spirālveida ķēdes, tādēļ kvarca kristāliem piemīt optiskā aktivitāte | α-kvarcs pie 573 °C pārvēršas par β-kvarcu |
| β-kvarcs | heksagonāls | līdzīgs α-kvarcam (tikai Si-O-Si saišu leņķi ir 155°), optiski aktīvs | β-kvarcs pie 870 °C pārvēršas par β-tridimītu |
| α-tridimīts | ortorombisks | normālā spiedienā atrodas metastabilā stāvoklī | |
| β-tridimīts | heksagonāls | līdzīgs α-tridimītam | β-tridimīts pie 1470 °C pārvēršas par β-kristobalītu |
| α-kristobalīts | tetragonāls | normālā spiedienā atrodas metastabilā stāvoklī | |
| β-kristobalīts | kubisks | līdzīgs α-kristobalītam | kūst pie 1705 °C |
| keatīts | tetragonāls | Si5O10, Si4O14, Si8O16 cikli | iegūts no amorfā SiO2 lielā spiedienā |
| koesīts | monoklīns | Si4O8 un Si8O16 cikli | rodas lielā spiedienā (augstākā, nekā keatīts) |
| stišovīts | tetragonāls | rutilam līdzīga struktūra, kurā silīcija koordinācijas skaitlis ir 6 | rodas, karsējot sevišķi lielā spiedienā pie 120 000 atm (augstākā, nekā koesīts) un ir pati blīvākā un inertākā SiO2 modifikācija (par 60% blīvāka nekā kvarcs) |
| melanoflogīts | kubisks | Si5O10, Si6O12 cikli | atrasts klatrātu tipa struktūru (klatrazila) iekšienē[2] |
| šķiedrainais SiO2 | ortorombisks | ķēžveida struktūra, līdzīga SiS2, kurā SiO4 tetraedri saistīti ar virsotnēm | |
| faujasīts | kubisks | ceolītiem līdzīga poraina struktūra |
Atsauces
[labot šo sadaļu | labot pirmkodu]- ↑ N.Ahmetovs. Neorganiskā ķīmija, Rīga, "Zvaigzne", 1978, 448. lpp.
- ↑ Rosemarie Szostak. Molecular sieves: Principles of Synthesis and Identification. Springer, 1998. ISBN 0751404802.
| Šis ar ķīmiju saistītais raksts ir nepilnīgs. Jūs varat dot savu ieguldījumu Vikipēdijā, papildinot to. |
|
