Ķīmiskā viela

Ķīmiskā viela ir vielas veids ar noteiktu ķīmisko sastāvu, neatkarīgi no šīs vielas izcelsmes.[1] Piemēram, jebkuram ūdens paraugam būs tās pašas īpašības un tā pati ūdeņraža un skābekļa attiecība, neatkarīgi no tā, vai šis ūdens paraugs ir ņemts no upes vai mākslīgi izgatavots laboratorijā. Tīru vielu mehāniskā ceļā nevar sadalīt citās vielās.[2] Tipiskas mājas apstākļos sastopamās vielas ir ūdens, vārāmā sāls (nātrija hlorīds) un cukurs (saharoze). Parastākie vielas agregātstāvokļi ir cietviela, šķidrums vai gāze. Viela var pāriet no viena agregātstāvokļa citā, mainoties temperatūrai vai spiedienam.
Ķīmiskās vielas jēdziens izveidojās 18. gadsimta beigās pēc ķīmiķa Žozefa Prusta darba izdošanas par vairāku tīru ķīmisko savienojumu uzbūvi.[3] Viņš secināja: "Visiem savienojuma paraugiem bija vienāds sastāvs; tātad visiem paraugiem ir tās pašas vielā sastopamo elementu masas proporcijas". Šī tēze kļuva pazīstama kā konstantā sastāva likums, kas kalpo par vienu no ķīmijas zinātnes pamatakmeņiem.
Jēdzienu "ķīmiska viela" bieži mēdz lietot nepareizi — ar nozīmi "sintētiska, mākslīgi iegūta viela"; kā pretēju nozīmi "dabiskai vielai". Tomēr dabiskas izcelsmes vielas ne ar ko neatšķiras no ķīmiski sintezētām vielām — tām ir tieši tāds pats sastāvs, molekulu telpiskā konfigurācija utt. Atšķirība var būt tikai nepilnīgi attīrītām vielām.
Vienkāršās vielas
[labot šo sadaļu | labot pirmkodu]Ķīmisko vielu, kuru ar parastajām ķīmiskajām reakcijām nevar sadalīt vai pārveidot citā vielā, sauc par vienkāršu vielu. Vienkārša viela sastāv no viena ķīmiskā elementa atomiem (kas var būt saistīti molekulās). Atomi savukārt sastāv no negatīvi lādētiem elektroniem, kuri grupēti ap kodolu, kas sastāv no pozitīvi lādētiem protoniem un neitrāliem neitroniem. Vienkāršas vielas paraugā visiem atomiem ir vienāds skaits protonu, kaut gan paraugā var būt pārstāvēti dažādi izotopi ar atšķirīgu neitronu skaitu.
Ķīmiskie savienojumi
[labot šo sadaļu | labot pirmkodu]Divi vai vairāki elementi, kas savienoti vienā vielā, veido ķīmisko savienojumu, kas sastāv no atomiem, kas ķīmiski saistīti molekulās, vai arī veido jonu tipa kristālrežģus. Kombinējot ap 120 zināmos elementus, iespējams iegūt milzīgu skaitu dažādu ķīmisko savienojumu. Pašlaik raksturoti un identificēti ap 30 miljoni ķīmisko savienojumu.[4] Tās vielas, kuru galvenās sastāvdaļas ir oglekļa un ūdeņraža atomi, sauc par organiskajām vielām, savukārt tās vielas, kas sastāv no citiem elementiem, sauc par neorganiskajām vielām.
Savienojumi, kuros to atomiem ir kopīgi elektronu pāri, tiek saukti par kovalentiem savienojumiem. Savienojumus, kas sastāv no pretēji lādētiem joniem, sauc par jonu savienojumiem, jeb sāļiem.
Ķīmisko vielu nosaukumi
[labot šo sadaļu | labot pirmkodu]Katrai ķīmiskai vielai ir unikāls sistemātiskais nosaukums.
Daudzi savienojumi pazīstami pēc to parastajiem, vienkāršākajiem jeb triviālajiem nosaukumiem, no kuriem lielākā daļa ir senāki kā sistemātiskais nosaukums. Jau ilgāku laiku pazīstamā cukura — glikozes — cikliskajai formai ir šāds sistemātiskais nosaukums: 6-(hidroksimetil)oksān-2,3,4,5-tetrols. Arī farmācijā ķīmiskajiem savienojumiem tiek piešķirti vienkāršāki nosaukumi, piemēram pretsāpju līdzeklim naproksēnam viens no "ķīmiskajiem" nosaukumiem ir (S)-6-metoksi-α-metil-2-naftalīnetiķskābe.
Ķīmiķi bieži apzīmē ķīmiskos savienojumus, lietojot ķīmiskās formulas, kuras satur pilnīgāku informāciju par savienojuma ķīmisko struktūru. Ir izveidotas arī datora videi draudzīgas sistēmas vielas informācijas ievadīšanai, piemēram CAS reģistra numurs un Starptautiskais ķimikālijas identifikators jeb InChI. Šādas sistēmas, jo sevišķi CAS skaitlis, ir noderīgas arī papīra formāta darbos, jo tās ērti lietojamas kā unikāli ciparu kodi specifiskas vielas apzīmēšanai.
| Parastais nosaukums | Sistemātiskais nosaukums | Ķīmiskā formula | Ķīmiskā struktūra | CAS reģistra numurs | InChI |
|---|---|---|---|---|---|
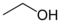
| alkohols, jeb etilalkohols |
etanols | C2H5OH | [64-17-5] | 1/C2H6O/c1-2-3/h3H,2H2,1H3 |
Vielas ieguve, attīrīšana, raksturošana un identifikācija
[labot šo sadaļu | labot pirmkodu]Bieži ir nepieciešams izolēt vielu no maisījuma, piemēram, iegūstot saharozi no cukurbietēm jeb vai pēc ķīmiskās reakcijas, kuras rezultātā parasti rodas ķīmisko vielu maisījums. Tas parasti tiek paveikts ar fiziskiem procesiem, piemēram, ar destilāciju, filtrēšanu un iztvaicēšanu. Šīs pašas metodes var izmantot arī tālākai vielas attīrīšanai. Kad ir iegūta tīra viela, var pētīt tās ķīmiskās un fiziskās īpašības, lai vielu varētu raksturot. Ķīmiskā sastāva noteikšanai var lietot ķīmiskās analīzes.
Atsauces un citāti
[labot šo sadaļu | labot pirmkodu]- ↑ Hill, J. W.; Petrucci, R. H.; McCreary, T. W.; Perry, S. S. General Chemistry, 4th ed., p5, Pearson Prentice Hall, Upper Saddle River, New Jersey, 2005.
- ↑ Ebbing, D. D.; Gammon, S. D. General Chemistry, 7th ed., p12, Houghton Mifflin, Boston, Massachusetts, 2002.
- ↑ Hill, J. W.; Petrucci, R. H.; McCreary, T. W.; Perry, S. S. General Chemistry, 4th ed., p37, Pearson Prentice Hall, Upper Saddle River, New Jersey, 2005.
- ↑ «Chemical Abstracts substance count». Arhivēts no oriģināla, laiks: 2000. gada 5. decembrī. Skatīts: 2006. gada 24. augustā.
Ārējās saites
[labot šo sadaļu | labot pirmkodu] Vikikrātuvē par šo tēmu ir pieejami multivides faili. Skatīt: Ķīmiskā viela.
Vikikrātuvē par šo tēmu ir pieejami multivides faili. Skatīt: Ķīmiskā viela.
- Krievijas Lielās enciklopēdijas raksts (krieviski)
|