Acetilacetons
| Acetilacetons | |
|---|---|
 Acetilacetona struktūrformula | |
| Ķīmiskā formula | C5H8O2 |
| Molmasa | 100,13 g/mol |
| Blīvums | 980 kg/m3 |
| Kušanas temperatūra | -23 °C |
| Viršanas temperatūra | 140 °C |
Acetilacetons (diacetilmetāns, pentān-2,4-dions, СН3–СО–СН2–СО–СН3) ir vienkāršākais β-diketons — savienojums ar divām karbonilgrupām molekulā, starp kurām ir viens oglekļa atoms (metilēngrupa). Acetilacetons ir bezkrāsains šķidrums ar patīkamu smaržu.
Iegūšana[labot šo sadaļu | labot pirmkodu]
Iegūst no acetona un acetanhidrīda bora trifluorīda klātienē:
- (CH3CO)2O + CH3–CO–CH3 → CH3–CO–CH2–CO–CH3
Var iegūt arī, kondensējot acetonu ar etilacetātu bāzu klātienē un paskābinot iegūto acetilacetonātu:
- NaOEt + EtO2CCH3 + CH3–CO–CH3 → NaCH3–CO–CH–CO–CH3 + 2 EtOH
- NaCH3–CO–CH–CO–CH3 + HCl → CH3–CO–CH2–CO–CH3 + NaCl
Īpašības[labot šo sadaļu | labot pirmkodu]
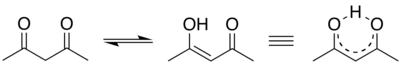
Acetilacetons pieder pie ketosavienojumiem, kam ir neparasti stabila enolforma (metanola šķīdumā ir 72% acetilacetona enolformas).[1] Tas izskaidrojams ar ūdeņraža saites veidošanos starp enolformas hidroksilgrupas ūdeņraža atomu un tuvumā esošās karbonilgrupas skābekļa atomu, kam ir enolformu stabilizējoša iedarbība:
Metilēngrupas, kura atrodas starp divām karbonilgrupām, ūdeņraža atoms ir ļoti kustīgs un viegli atšķeļas, veidojot acetilacetona anjonu.
Iedarbojoties uz β-diketoniem ar fenilhidrazīnu, hidroksilamīnu, vai tamlīdzīgiem reaģentiem, viegli var iegūt heterocikliskus savienojumus - pirazola atvasinājumus.
β-Diketoni, vārot tos ar sārmiem, sadalās par skābēm un ketoniem:
- СН3–СО–СН2–СО–СН3 + NaOH → СН3COONa + СН3–СО–СН3
Izmantošana[labot šo sadaļu | labot pirmkodu]
Acetilacetonu izmato analītiskajā ķīmijā, jo tas ar metālu joniem dod noturīgus kompleksos savienojumus (acetilacetonātus). Radioķīmijā šo īpašību lieto radioaktīvo izotopu izdalīšanai. Acetilacetonu lieto arī organiskajā sintēzē.
Atsauces[labot šo sadaļu | labot pirmkodu]
- ↑ O. Neilands. Organiskā ķīmija. R:, Zvaigzne, 1977, 473. lpp.
| ||||||||