Ūdeņraža saite
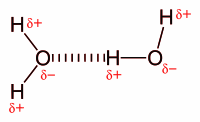
Ūdeņraža saite ir īpašs ķīmiskās saites veids, kas iespējams ūdeņraža atoma sevišķo īpašību dēļ. Tā kā tam nav elektronu čaulas starp kodolu un vērtības elektroniem, ūdeņraža vienīgais valences elektrons atrodas tieši kodola iedarbības sfērā. Ja ūdeņraža atoms ir savienojies ar kādu stipri elektronegatīvu atomu (piemēram, skābekli, slāpekli vai fluoru), ūdeņraža elektrons iesaistās kovalentās saites kopīgajā elektronu pārī. Šis pāris tiek novirzīts uz elektronegatīvākā atoma pusi, bet ūdeņraža atoma kodols (protons) ar savu pozitīvo lādiņu var iedarboties ar kāda cita atoma nesaistošo elektronu pāri. Šādi iedarboties var tikai ūdeņradis, jo citu elementu atomu pozitīvie kodoli ir ekranēti ar kodolam tuvajām aizpildītajām elektronu čaulām.

Tādējādi molekulas X−A−H ūdeņradis, kas kovalenti saistīts ar stipri elektronegatīvu atomu A, var saistīties ar citas molekulas B−Y elektronegatīvo atomu B (vai arī tas pašas molekulas citu, tālāku, atomu), veidojot vairāk vai mazāk stabilu kompleksu X−A−H•••B−Y, kur ••• - ūdeņraža saite. Viena molekula var veidot vairākas ūdeņraža saites, piemēram, ūdens molekula H2O var tikt saistīta ar četrām ūdeņraža saitēm - divas var veidot ūdens molekulas ūdeņraža atomi, bet skābekļa atoma divi nesaistošie elektronu pāri var veidot divas ūdeņraža saites ar citu molekulu ūdeņraža atomiem. Ar to izskaidrojamas ūdens (un arī daudzu citu vielu, piemēram, amonjaka, spirta) neparasti augstās kušanas un viršanas temperatūras, jo visai vieglās un kustīgās ūdens molekulas tiek saistītas savā starpā ar daudzām ūdeņraža saitēm. Ūdeņraža saites ir atbildīgas arī par citām ūdens anomālajām īpašībām (augsto siltumietilpību, viskozitāti).
Ūdeņraža saites stiprība[labot šo sadaļu | labot pirmkodu]
Ūdeņraža saites stiprība var būt dažāda, tomēr tā ir jūtami vājāka, nekā kovalentā saite, taču stiprāka, nekā van der Vālsa mijiedarbība. Parasti ūdeņraža saites enerģija ir no dažiem kJ/mol līdz dažiem desmitiem kJ/mol. Visstiprākā ūdeņraža saite ir šķidrā fluorūdeņradī (155 kJ/mol) - šeit veidojas stabils fluorohidrogenāta jons HF2− (sk. arī hidrogenāti).
Ūdeņraža saišu veidi[labot šo sadaļu | labot pirmkodu]

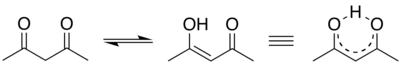
Ir iespējamas starpmolekulārās (intermolekulārās) ūdeņraža saites un iekšmolekulārās (intramolekulārās) ūdeņraža saites. Iekšmolekulārās ūdeņraža saites nosaka daudzu dabasvielu - proteīnu un nukleīnskābju - struktūru. Ūdeņraža saites nelielās enerģijas dēļ tā ķermeņa temperatūrā viegli rodas un viegli pārtrūkst, kas ir ļoti būtiski dažādos bioloģiskos procesos. Pastāv uzskats, ka molekulārās konfigurācijas, kas veidojas ar ūdeņraža saišu starpniecību, var būt saistītas ar atmiņas mehānismiem.[1]
Atsauces[labot šo sadaļu | labot pirmkodu]
- ↑ N.Ahmetovs. Neorganiskā ķīmija, Rīga, "Zvaigzne", 1978
|
