Atomfizika
Atomfizika ir fizikas nozare, kas pēta atomu kā izolētu sistēmu, kas sastāv no atoma kodola un elektroniem. Sākotnēji tika pētīts elektronu izvietojums atomos un to izmaiņas. Atomfizikas nozarē iekļaujas gan neitrālu atomu, gan jonu pētījumi.
Atoma uzbūves pētījumi
[labot šo sadaļu | labot pirmkodu]Radioaktivitātes atklāšana
[labot šo sadaļu | labot pirmkodu]Vārds atoms ir cēlies no sengrieķu valodas (atomos) un tulkojumā nozīmē nedalāms. Sengrieķu zinātnieki uzskatīja, ka visām vielām, kas eksistē, ir dalāmības robeža - šī uzskata dēļ viņi vissīkāko daļiņu nosauca par atomu. Šo uzskatu fizikā lietoja līdz 19. gadsimta beigām, kad tika secināts - atomam ir ļoti sarežģīta uzbūve.
Tika novērots, ka atoms spēj absorbēt un izstarot gaismu. No elektrodinamikas zināms, ka šādu parādību var izraisīt tikai elektriski lādētu daļiņu sistēmas. Arī elektriskās strāvas un elektrolīzes pētījumi parādīja, ka atomos atrodas lādētas daļiņas. 1895. gadā angļu fiziķis Dž. Dž. Tomsons atklāja un pierādīja, ka atoms sastāvā ir elektroni, kuri ir negatīvā lādiņa nesēji.
1896. gadā franču zinātnieks Anrī Bekerels atklāja radioaktivitāti, eksperimentējot ar Urāna savienojumiem. Tika novērots, ka elektriskajā laukā šīs radioaktīvais starojums sadalās trijās sastāvdaļās. Šīs sastāvdaļas nosauca par alfa (α) starojumu, beta (β) starojumu un gamma (γ) starojumu.
Eksperimentu laikā elektriskajā laukā alfa starojums novirzījās uz negatīvā pola pusi, beta starojums novirzījās un pozitīvo pusi, bet gamma starojums nemainīja savu plūšanas virzienu. Pārbaudot šos starojumus magnētiskajā laukā, bija novērots, ka gamma starojums nemainīja savu plūšanas virzienu, bet alfa un beta starojums novirzījās perpendikulāri magnētiskā lauka virzienam.
Šo eksperimentu rezultātā pierādījās, ka alfa starojums ir pozitīvi lādētu daļiņu plūsma. Vēlāk noskaidrojās, ka alfa daļiņas ir hēlija atoma kodoli un, ka tās ir saliktas daļiņas, bet beta starojums ir negatīvi lādētu daļiņu plūsma, un šis daļiņas nosauca par beta daļiņām. Tālākie eksperimenti liecināja, ka beta daļiņas ir elektroni. gamma starojumu definēja kā elektromagnētisko viļņu kvantu jeb fotonu plūsmu. Alfa un beta lādēto daļiņu plūsmas faktiski ir elektriskā strāva.
Novērojumi pierādīja, ka neeksistē tādas radioaktīvas vielas, kuras atomi vienlaikus izstarotu visus trīs starojuma veidus. Šajos eksperimentos šie starojumi parādījās tādēļ, ka svina trauciņā, ko ievietoja elektriskajā laukā vai magnētiskajā laukā, bija radioaktīvu vielu maisījums, tātad tajos atradās dažādi atomi. Bez urāna tur atradās arī citu vielu radioaktīvie atomi, kuri radās urānam atomiem sabrūkot.
Rezerforda alfa daļiņu izkliedes eksperimenti
[labot šo sadaļu | labot pirmkodu]1911.g. tika veikts eksperiments, lai uzzinātu daļiņu novietojumu atomā un to veica angļu fiziķis Ernests Rezerfords. No konteinera, kurā atradās radioaktīvā viela, kas izstaroja alfa daļiņas, šo daļiņu kūlis krita uz plānu zelta plāksnīti. Šī plāksnīte bija tik plāna, lai alfa daļiņas teorētiski nesadurtos vairāk kā ar vienu vielas atomu. Pēc šīs sadursmes ar plāksnīti alfa daļiņas tika izkliedētas. Lai noskaidrotu daļiņu izkliedes virzienu, tika izmantots mikroskops. Mikroskopu novietoja izstaroto daļiņu ceļā, lai novērošanas virziens ar daļiņu sākotnējo kustības virzienu veidotu dažādus leņķus. Mikroskopa priekšā tika novietots ekrāns, uz kura varēja redzēt visu norisi. Šis ekrāns tika pārklāts ar vielu, kas satiekoties ar alfa daļiņām, luminiscējās uz ekrāna. Daļiņu satikšanās triecienu rezultātā tika novēroti luminiscences uzliesmojumi, kurus varēja novērot dažādos virzienos apkārt punktam, kurā alfa daļiņu kūlis triecās pret ekrānu.
E. Rezerfords novēroja, ka lielākā daļa alfa daļiņu plūsmas daļiņas izgāja cauri zelta plāksnītei nenovirzoties no sava kursa, bet dažas novirzījās un veidoja, salīdzinot ar sākotnējo virziena, samērā lielus leņķus. No izdarītajiem pētījumiem viņš secināja, ka atoma aizņemtās telpas lielākā daļa alfa daļiņas nekādu pretestību nebija satikušas. Šajā telpā varēja atrasties tikai elektroni, kuri savas mazās masas dēļ nebija spējīgi mainīt alfa daļiņu virzienu. Tas nozīmē, ka visa atoma masa, kas novirzīja alfa daļiņu plūsmu, bija koncentrējušās nelielā telpas daļā, kuru Rezerfords nosauca par atoma kodolu.
Pieņēma, ka atoms un tā kodols ir sfērisks veidojums. Tā rādiusu varēja noteikt, zinot vielas atoma masu un blīvumu. Šos lielumus varēja izmērīt eksperimentāli. Aprēķinātie rādiusi atomam bija robežās no 0.53 * 10-10m (ūdeņraža atomam) un 1.5 * 10-10m (urāna atomam). Rezultātā tika pieņemts, ka normālā stāvoklī visu atomu rādiusi ir aptuveni 10-10m.
Tika aprēķināti arī atoma kodolu rādiusi. Rādiusa garums bija aptuveni 10-15m. Tas nozīmē, ka atoma kodola rādiuss ir 105 reizes mazāks par paša atoma rādiusu. Lai varētu uzskatāmi salīdzināt kodola un atoma izmērus, var iedomāties - ja atoms ir lode ar rādiusu 1 km jeb 105cm, tad kodola rādiuss šajā mērogā būs aptuveni 1 cm.
Atoma uzbūves modeļi
[labot šo sadaļu | labot pirmkodu]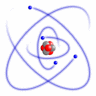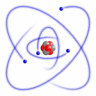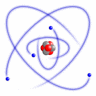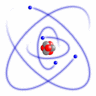
1903.g. angļu fiziķis Dž. Dž. Tomsons bija izveidojis pirmo atoma modeli. Pēc Tomsona modeļa teorijas atoma pozitīvais lādiņš ir izvietots vienmērīgi pa visu tā tilpumu. Bet šajā atomā atrodas arī negatīvie elektroni, kuri iedarbojoties uz pozitīvajiem lādiņiem, neitralizējot tos. Šajā atoma modelī nebija kodola, tādējādi Ernesta Rezerforda eksperiments bija pretrunā ar šo modeli.
1911.g. Ernests Rezerfords, pamatojoties uz savu eksperimentu, izveidoja atoma modeli, kuru mēs pazīstam kā Rezerforda jeb planetāro atoma modeli. Salīdzinājumā ar Tomsona izveidoto modeli, šis modelis bija absolūtāks.
Šo modeli sauc par planetāro modeli, tādēļ, ka tajā esošie pozitīvie lādiņi atrodas atoma kodolā, bet tā elektroni riņķo ap kodolu, tāpat kā kosmosā planētas riņķo ap Sauli. Elektroniem ap kodolu liek kustēties pa orbītu centrtieces spēks, bet starp pozitīvo kodolu un negatīvajiem elektroniem iedarbojas elektriskais Kulona pievilkšanas spēks. Tiek pieņemts, ka atoms normālos stāvokļos ir elektroneitrāla sistēma, tādēļ, zinot kodolā esošo pozitīvo lādiņu, var aprēķināt ap to riņķojošo elektronu negatīvo lādiņu.
Lai noteiktu atoma kodola lādiņu ir izveidotas dažādas metodes, bet visas metodes ir devušas vienādus slēdzienus, ka atoma kodola lādiņš ir vienāds ar Z * e,
kur Z — attiecīgā ķīmiskā elementa atomskaitlis pēc Dmitrija Mendeļejeva izveidotās Ķīmisko elementu periodiskās tabulas un
e — ir pozitīvais lādiņš, kurš ir vienāds ar elektrona negatīvo lādiņu.
Tādējādi atomos, kas sastāda elementus ar kārtas numuru Z, ap kodolu riņķo Z elektroni : ūdeņraža atoma ir viens Z; hēlija atomā ir 2 Z; litija atomā ir 3 Z utt..
Bora postulāti
[labot šo sadaļu | labot pirmkodu]Lietojot Rezerforda atoma modeli, tika konstatētas vairākas nepilnības, kurus nebija iespējams izskaidrot ar klasiskās fizikas likumsakarībām. Tādēļ 1913.gada dāņu zinātnieks Nilss Bors planetāro modeli papildināja ar saviem pieņēmumiem jeb postulātiem, Šos postulātus, kurus nosauca par Bora postulātiem, vēlāk pamatoja ar kvantu mehānikas palīdzību.
Bora postulātus var formulēt šādi:
- Apkārtesošie elektroni ap atoma kodola var pārvietoties tikai pa noteiktu trajektoriju jeb orbītām. Ja sanumurētu ūdeņraža atomā stacionārās orbītas, sākot no atoma kodola tuvākajām orbītām, tad izveidotos orbīta rādiusu attiecība kā orbītu kārtas skaitļa kvadrāti : r1:r2:r3....= 1:4:9:....
- Elektroni kustoties stacionārajā orbītā elektromagnētiskos viļņus neabsorbē un neizstaro. Tas nozīmē, ka elektronam atrodoties stacionārajā orbītā, tam ir noteikta enerģija. Elektronu enerģija palielinās no kodola tuvākās orbītas līdz tālākajai orbītai esošajiem elektroniem.
- Elektronam absorbējot enerģiju, tas pāriet uz tālāko orbītu, bet izstarojot, tas pārvietojas uz tuvāko orbītu kodolam. Ir pieņemts, ka orbītu enerģijas vērtības ir stingri noteiktas, tādēļ pārejām starp tām ir stingri noteiktas enerģijas vērtības. Katrā pārejā tiek izstarots vai absorbēts viens elektromagnētisko viļņu kvants, tādējādi kvanta enerģija ir vienāda ar elektrona enerģijas izmaiņu pārejā.
E = En — Em
E - kvanta (fotona) enerģija; En un Em — elektrona enerģijas attiecība uz orbītām n un m.
Pēc Maksa Planka izveidotās teorijas, kvanta enerģija ir proporcionāla elektromagnētiskā viļņa frekvencei:
E = hν
kur h — Planka konstante un ν — frekvence.
Atoms var absorbēt un izstarot tikai noteiktas frekvences jeb viļņa garuma elektromagnētiskos viļņus. Šo frekvenci var aprēķināt, lietojot augšējās divas formulas :
ν = (En — Em) / h
Atoma absorbcijas spektrs, kas veidojas starojuma absorbcijas procesā, un emisijas spektrs, kas veidojas emisijas procesā, ir līniju spektri. Tādējādi ar Bora postulātiem tika novērsta planetārā atoma modeļa pretrunas.
Enerģijas absorbcija un emisija atomos
[labot šo sadaļu | labot pirmkodu]
Visvienkāršākais no atomiem ir ūdeņraža atoms, tādēļ arī enerģijas absorbcijas un emisijas likumsakarības tajā var redzēt visspilgtāk. Ūdeņraža elektrisko čaulu veido tikai viens elektrons. Šis vienīgais elektrons cenšas pieņemt stāvokli, kurā tam būtu vismazākā enerģija. Šis stāvoklis atbilst atoma kodola vistuvākās orbītas stāvoklim, tādēļ to arī sauc par normālo stāvokli.
Lai elektrons spētu pāriet no tuvākās orbītas uz tālāko orbītu, tam ir jāpievada tāds daudzums enerģijas, lai nodrošinātu elektrona pāreju. Absorbējot šo enerģiju atoms iegūst jaunu stāvokli, kuru sauc par ierosinātu stāvokli. Ja atomam atņem elektronu, tad atoms pārveidojas par pozitīvi lādētu jonu.
Atoms, kurš ir ierosinātā stāvoklī, nekad nepastāv ilgāk par 10-8 s. Pēc šā perioda elektrons pāriet uz kādu atomam tuvāku orbītu, tādējādi emitējot lielu daudzumu enerģijas, kas bieži tiek izstarots elektromagnētisko viļņu veidā. Ir pierādīts, ka katrai pārejai atbilst savs enerģijas kvants un, tādēļ spektrā vienādie enerģijas kvanti izveido vienu spektra līniju, bet pārejas, kas beidzas uz 1. orbītas, veido spektra līnijas sērijas. Beidzoties uz 1. orbītas, veidojas spektra līniju sērija, kuru sauc par Laimana sēriju. Tā atrodas ultravioletā starojuma spektra apgabalā un vizuāli ir grūti novērojama.
Elektroni, kas beidzas uz 2. orbītas veido spektra līnijas sērijas. , kuru sauc par Balmeru sēriju. Šīs spektra līnijas ir vienīgās kuras atrodas redzamajā apgabalā, bet pārējās, kuras beidzas uz 3., 4., 5. utt. orbītas, atrodas infrasarkano spektra daļā un vizuāli nav novērojami.
Turpinoties pētījumiem, izrādījās, ka Bora atoma modelis arī ir nepilnīgs. Pēc šī modeļa varēja tikai daļēji izskaidrot ūdeņraža uzbūvi, bet šis modelis nespēja izskaidrot sarežģītāku atomu uzbūvi. Tāpat arī Bora postulāti nebija pamatojami ar klasiskās mehānikas metodēm.
Atoma uzbūves izskaidrojumu sniedza kvantu mehānika, kurus radīja vācu fiziķis Verners Heizenbergs, formulējot Heizenberga nenoteiktības principu (1927.gadā), un austriešu fiziķis Ervīns Šrēdingers izstrādājot Šrēdingera vienādojumu (1926.gadā). Kvantu mehānika mūsdienu fiziķiem un ķīmiķiem sniedz apmierinošu pamatojumu par atoma modeļa struktūras veidošanos. Tā izpratnei ir nepieciešamas plašas zināšanas matemātikā.
Skatīt arī
[labot šo sadaļu | labot pirmkodu]| Šis ar fiziku saistītais raksts ir nepilnīgs. Jūs varat dot savu ieguldījumu Vikipēdijā, papildinot to. |
|
