Nātrija kālija tartrāts
| Nātrija kālija tartrāts | |
|---|---|
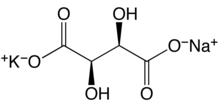 Nātrija kālija tartrāta struktūrformula 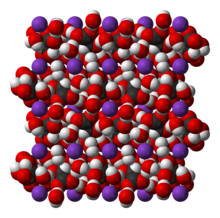 Segnetsāls kristāla uzbūve (paraelektriskajā fāzē) | |
| Citi nosaukumi |
segnetsāls (nosaukums kristālhidrātam), E337 |
| CAS numurs | 304-59-6 |
| Ķīmiskā formula | KNaC4H4O6·4H2O |
| Molmasa | 282,1 g/mol |
| Blīvums | 1790 kg/m3 |
| Kušanas temperatūra |
≈348 K (75 °C)[1] 70-80 °C |
| Viršanas temperatūra |
≈408 K (135 °C) (sadalās)[1] 215 °C (atšķeļ ūdeni)[2] |
| Šķīdība ūdenī |
54 g/100 g H2O (15 °C) 630 g/l pie 20 °C[3] |
Nātrija kālija tartrāta tetrahidrāts jeb segnetsāls[4] ir vīnskābes nātrija un kālija dubultsāls kristālhidrāts. Segnetsāls ir ieguvis savu nosaukumu no franču aptiekāra Pjēra Seņeta (Pierre Seignette) uzvārda — viņš ieguva šo sāli ap 1655. vai 1672. gadu.[5] vai 1675. gadā (dažādos avotos ir sastopami dažādi dati). Citos avotos sastopams arī vārds E. Seņets.[6]
Fizikālās īpašības un izmantošana tehnikā
[labot šo sadaļu | labot pirmkodu]Pēc izskata sāls ir no bezkrāsaina līdz bāli zilam. Ūdenī šķīst labi (15°C 54g/100g H2O),[7] 30 °C pat 1390 g/l,[6] turklāt ir higroskopisks. Tomēr bezūdens sāls acīmredzot ir mazšķīstošs, jo iegūšanas reakcijā izkrīt nogulsnēs. 55,6 °C viela sāk sadalīties (iespējams, zaudēt kristalizēto ūdeni).[8] 70—80 °C segnetsāls kūst, 130—140 °C — sadalās. Nātrija kālija tartrāts ir aptuveni 1,79 reizes blīvāks par ūdeni (20°С). Kristālu uzbūve atbilst rombiskajai kristāliskajai sistēmai (parasti sāls kristalizējas rombveidīgās prizmās ar 12 skaldnēm, no tiem 2 ir pinakoīdi; leņķi starp divām sānu skaldnēm ir 163° un 40°[9]).

Šī viela ir īpatnēja ar to, ka ir pjezoelektriķis, viens no pirmajiem, ko atklāja (Pjērs un Žaks Kirī, 1880. g.). Tāpēc vēl starpkaru posmā ASV (firmas BRUSH ASV patents Nr. 2483647[10]), vēlāk arī citur, piem., PSRS — 1941.—1942. g.[11] (īpaši plaši — pēckara ekonomiskās atjaunotnes "elektropreču buma" laikā, 20. gs. 50. gados) to sāka izmantot plašu atskaņotāju noņēmējos, mikrofonos un telefonu un citās klausulēs, arī dzirdes aparātos. Salīdzinājumā ar citiem pārveidotājiem segnetsāls izejas spriegums ir ļoti liels (pat trīstūkstoš reižu lielāks[11][12]). Taču no segnetsāls izgatavotus pārveidotājus nedrīkst glabāt mitrās vietās, jo sava higroskopiskuma dēļ sāls pakāpeniski izplūst.
Turklāt segnetsāls ir arī segnetoelektriķis, turklāt pirmais atklātais segnetoelektriķis (1894. g.). Tieši šim sālim par godu tika nosaukta visa vielu grupa, kurā ietilpst piroelektriķi ar maināmu polarizācijas virzienu. Segnetsālim ir raksturīgas divas Kirī temperatūras — apakšējā (—15 °C) un augšējā (22,5 °C). Tikai šajā temperatūru intervālā viela uzrāda segnetoelektriskās īpašības.
Ķīmiskās īpašības un izmantošana ķīmijā
[labot šo sadaļu | labot pirmkodu]Tā kā nātrija kālija tetrahidrāts ir vīnskābes (hirāla savienojuma) sāls, tam acīmredzot pastāv vairākas formas. Dabā gan ir sastopama tikai L-(+)-vīnskābe.
Nātrija kālija tartrāts ir Fēlinga reaģenta sastāvdaļa. Tā sastāva tas ticis izmantots cukuru pierādīšanā. Segnetsāli izmanto arī spoguļu sudrabošanā pēc Heinrihsona metodes.[13] To izmanto arī organiskajā sintēzē kā deemulģējošu vielu ūdens šķīdumos, parasti reakcijās, kur izmanto alumīnija hidrīdu. Arī biureta reaģents satur nātrija kālija tartrātu.
Laboratorijās to iegūst nogulsnēs sīkkristāliskā veidā, pievienojot karstam kālija hidrogēntartrāta (bitartrāta) šķīdumam stehiometrisku Na2CO3 daudzumu.

Lielāki sāls monokristāli ir izaudzēti kosmosā (vājas gravitācijas un konvekcijas apstākļos), piem., amerikāņu orbitālajā stacijā Skylab. Mūsdienās tos audzē arī rūpnieciski.[14]
Izmantošana citur
[labot šo sadaļu | labot pirmkodu]Nātrija kālija tartrāts ir arī pārtikas piedeva (antioksidants E337). Tam ir sāļa, vēsinoša garša. Segnetsāli izmanto arī cepampulveros.[15] Turklāt tas tiek izmantots medicīnā kā caurejas līdzeklis (aptiekārs Seņets to arī esot lietojis tieši šim nolūkam[9]). Pašlaik segnetsāli tālab bieži lieto Zeidlicas pulvera formā.[16]
Literatūra
[labot šo sadaļu | labot pirmkodu]- Krūmiņš J., Branka V., Puķītis P., Tiltiņš E. Fizika 11. klasei. Rīga: "Zvaigzne ABC", 1995. — 312 lpp.
- http://www.dabatev.lv/index.php/e-numuru-saraksts.html?enummuriTask=enummuriDetails&catid=5&enummuriId=114 Arhivēts 2016. gada 4. martā, Wayback Machine vietnē.
- https://archive.today/20121225062638/www.nesenenko.narod.ru/BOOKS/segnet.html (krieviski)
Atsauces
[labot šo sadaļu | labot pirmkodu]- ↑ 1,0 1,1 http://chemister.pp.ru/Database/search.dbp?action=synthesis&dbid=1&id=4518[novecojusi saite]
- ↑ Справочник химика. Том II. Основные свойства неорганических и органических соединеный. Л.,"Химия", 1971 (krieviski)
- ↑ Kaliumnatriumtartrat Arhivēts 2010. gada 10. maijā, Wayback Machine vietnē. (vāciski)
- ↑ Dainuvīte Guļevska (redaktors). Zinātnes un tehnoloģijas vārdnīca. Rīga : Norden AB, 2001. 590. lpp. ISBN 978-9-98-493835-6. Arhivēts no oriģināla, laiks: 2019. gada 2. septembrī. Skatīts: 2020. gada 16. maijā.
- ↑ http://www.websters-online-dictionary.org/Ro/Rochelle_salt.html[novecojusi saite] (angliski)
- ↑ 6,0 6,1 http://bse.sci-lib.com/article100711.html (krieviski)
- ↑ http://chemister.pp.ru/Database/search.dbp?action=synthesis&dbid=1&id=4518[novecojusi saite] (krieviski)
- ↑ https://web.archive.org/web/20070209031023/http://www.cultinfo.ru/fulltext/1/001/008/100/711.htm (krieviski)
- ↑ 9,0 9,1 https://archive.today/20121225062638/www.nesenenko.narod.ru/BOOKS/segnet.html (krieviski)
- ↑ http://www.freepatentsonline.com/2483647.html (angliski)
- ↑ 11,0 11,1 http://vivovoco.rsl.ru/VV/MISC/2/PIEZO.HTM Arhivēts 2006. gada 9. oktobrī, Wayback Machine vietnē. (krieviski)
- ↑ http://rimstar.org/materials/piezo/rochelle1.htm (angliski)
- ↑ http://www.pajero.us/repair/files/6.shtml Arhivēts 2009. gada 20. aprīlī, Wayback Machine vietnē. (krieviski)
- ↑ http://www.crys.ras.ru/achievr.html Arhivēts 2009. gada 23. martā, Wayback Machine vietnē. (krieviski)
- ↑ http://dic.academic.ru/dic.nsf/ntes/4211/СЕГНЕТОВА (krieviski)
- ↑ http://www.encyclopedia.com/doc/1E1-Rochelslt.html (angliski)
