Kālijs
| Kālijs | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
  Kālija gabaliņš tetrahidrofurānā un kālija jonu dotā violetā liesmas krāsa | |||||||
| Oksidēšanas pakāpes | +1 | ||||||
| Elektronegativitāte | 0,82 | ||||||
| Blīvums | 856 kg/m3 | ||||||
| Kušanas temperatūra | 336,53 K (63,38 °C) | ||||||
| Viršanas temperatūra | 1032 K (759 °C) | ||||||
| Īpatnējā pretestība | (20 °C) 7,2×10-8 Ω·m | ||||||
| Skaņas ātrums | (20 °C) 2000 m/s | ||||||
| Van der Vālsa rādiuss | 275 nm | ||||||
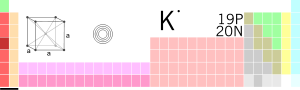
Kālijs ir ķīmiskais elements ar simbolu K un atomskaitli 19. Kālijs ir viens no sārmu metāliem. Dabā brīvā veidā šis elements nav sastopams, jo ķīmiski ir ļoti aktīvs. Brīvā veidā kāliju iegūst, elektrolizējot tā savienojumu — parasti hlorīda vai hidroksīda kausējumus. Kālijs savienojumos var būt tikai vienvērtīgs, ar oksidēšanas pakāpi +1.
Vēsture[labot šo sadaļu | labot pirmkodu]
Kālijs bija pirmais metāls, kas tika izolēts elektrolīzes rezultātā.[1] To 1807. gadā paveica angļu ķīmiķis sers Hamfrijs Deivijs (Humphry Davy).
Kālija nosaukums ir cēlies no arābu vārda القَليَه, al-qalya, kas tulkojumā nozīmē "pelni" vai arī "sārms". Angļu valodā to sauc par potassium, jo to agrāk visvairāk ieguva no potašas (K2CO3).
Atrašanās dabā[labot šo sadaļu | labot pirmkodu]
Dabā kālijs ir sastopams galvenokārt hlorīdu un sulfātu veidā, kā arī alumosilikātos (kālija laukšpats). Zemes garozā tas ir septītais izplatītākais ķīmiskais elements.[1] Kālijs sastāv no diviem stabiliem izotopiem:[2] kālijs-39 (93,2581% no kopējā kālija daudzuma dabā) un kālijs-41 (6,7302%).[3] Atlikušos 0,0117% no dabā sastopamā kālija veido radioaktīvais kālijs-40, kura pussabrukšanas periods ir 1,265×109 gadi.[3]
Cilvēka organismā kāliju saturošiem savienojumiem ir liela nozīme normālā sirdsdarbībā un nervu impulsu pārvadīšanā. Ar kāliju saturošiem savienojumiem bagātas ir auzu pārslas, bet salīdzinoši daudz kāliju saturošu vielu ir arī redīsos, ķiršos un kartupeļos. Diennaktī cilvēkam nepieciešams uzņemt organismā 2,5–5 g kālija.
Fizikālās īpašības[labot šo sadaļu | labot pirmkodu]
Kālijs ir sudrabaini balts, mīksts un plastisks sārmu metāls, ko var griezt ar nazi.
Ķīmiskās īpašības[labot šo sadaļu | labot pirmkodu]
Kālijam piemīt sārmiem raksturīgas ķīmiskās īpašības. Ļoti aktīvi reaģē ar nemetāliem, ūdeni, skābēm. Veicot šādus eksperimentus, ir jābūt ļoti piesardzīgiem. Degot gaisā, veido kālija superoksīdu jeb peroksiperoksīdu KO2. Tas reaģē arī ar gaisā esošo skābekli, veidojot oksīdu K2O un peroksīdu K2O2. Ar ūdeni kālijs reaģē ļoti enerģiski, parasti reakcijas gaitā tas aizdegas (rodas kālija hidroksīds KOH). Paaugstinātā temperatūrā reaģē arī ar slāpekli (veidojot kālija nitrīdu).
Izmantošana[labot šo sadaļu | labot pirmkodu]
Kāliju sakausējumos kopā ar nātriju izmanto kā dzesētāju kodolreaktoros. No kālija iegūst kālija peroksīdu K2O2, ko izmanto zemūdenēs un kosmosa kuģos ogļskābās gāzes CO2 uztveršanai un skābekļa O2 reģenerēšanai. Kāliju izmanto arī organiskajās sintēzēs. Kālija hlorīds KCl ir svarīgs minerālmēslošanas līdzeklis. Kālija hidroksīdu KOH izmanto ziepju ražošanā, skābju neitralizēšanā un sāļu iegūšanā, kā arī tas ir elektrolīts akumulatoros.
Atsauces[labot šo sadaļu | labot pirmkodu]
| Vikikrātuvē par šo tēmu ir pieejami multivides faili. Skatīt: kālijs |
- ↑ 1,0 1,1 «Potassium» (angliski). Los Alamos National Laboratory. Skatīts: 2012-03-05.
- ↑ «The Element Potassium» (angliski). Jefferson Lab. Skatīts: 2011-08-10.
- ↑ 3,0 3,1 «Isotopes of the Element Potassium» (angliski). Jefferson Lab. Skatīts: 2011-08-10.
Ārējās saites[labot šo sadaļu | labot pirmkodu]
 Vikikrātuvē par šo tēmu ir pieejami multivides faili. Skatīt: Kālijs.
Vikikrātuvē par šo tēmu ir pieejami multivides faili. Skatīt: Kālijs.
- Latvijas Nacionālās enciklopēdijas šķirklis
- Encyclopædia Britannica raksts (angliski)
- Brockhaus Enzyklopädie raksts (vāciski)
- Krievijas Lielās enciklopēdijas raksts (krieviski)
- Encyclopædia Universalis raksts (franciski)
- Enciklopēdijas Krugosvet raksts (krieviski)
| Šis ar ķīmiju saistītais raksts ir nepilnīgs. Jūs varat dot savu ieguldījumu Vikipēdijā, papildinot to. |
| H | He | ||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | As | Br | Kr | ||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Te | I | Xe | |||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Rn | ||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Sārmu metāli | Sārmzemju metāli | Lantanīdi | Aktinīdi | Pārejas metāli | Citi metāli | Pusmetāli | Citi nemetāli | Halogēni | Cēlgāzes |
|