Piridīns
| Piridīns | |
|---|---|
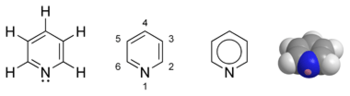 Piridīna dažādu veidu struktūrformulas un molekulas modelis  Pudele ar piridīnu | |
| Citi nosaukumi | azabenzols, azīns |
| CAS numurs | 110-86-1 |
| Ķīmiskā formula | C5H5N |
| Molmasa | 79,1 g/mol |
| Blīvums | 981,9 kg/m3 |
| Kušanas temperatūra | -41,6 °C |
| Viršanas temperatūra | 115,2 °C |
| Šķīdība ūdenī | jaucas jebkurās attiecībās |
Piridīns (C5H5N) ir heterociklisks, slāpekli saturošs, aromātisks organiskais savienojums. Tas pieder pie sešlocekļu heterocikliem. Piridīns ir bezkrāsains šķidrums ar raksturīgu asu, nepatīkamu smaku. Jaucas ar ūdeni un organiskiem šķīdinātājiem. Piridīns ir vāja bāze un ar stiprām neorganiskām skābēm veido sāļus (tos sauc par piridīnija sāļiem, piemēram, piridīnija perhlorāts). Viegli veido kompleksos savienojumus un dubultsāļus.
Vēsture
[labot šo sadaļu | labot pirmkodu]Pētot kaulu eļļu, ko ieguva kaulu sausajā destilācijā, ķīmiķis Andersons 1846. gadā ieguva nepazīstamu vielu, kuru varēja uzskatīt par benzola analogu, kam viena CH grupa aizvietota ar slāpekļa atomu (šo domu pirmo reizi izteica Kerners 1869. gadā privātā vēstulē Kanicāro). Pēc gada Djuārs (Dewar) neatkarīgi no Kernera ieteica šo pašu formulu, kuru vēlāk savos darbos apstiprināja arī citi ķīmiķi. 1879. gadā A. Višegradskis minēja iespēju, ka visas "augu bāzes", kā tolaik dēvēja alkaloīdus, ir piridīna vai hinolīna atvasinājumi, bet 1880. gadā Kēnigss pat ierosināja par alkaloīdiem saukt tikai tās augu bāzes, ko var uzskatīt par piridīna derivātiem. Tomēr mūsdienās par alkaloīdiem uzskata daudz vairāk vielu.
Atrašanās dabā
[labot šo sadaļu | labot pirmkodu]Piridīna gredzens ir daudzu alkaloīdu un citu dabasvielu molekulu struktūras pamatā. Pazīstami piridīna atvasinājumi ir nikotīnskābe (PP vitamīns), piridoksīns (B6 vitamīns), nikotīns, anabazīns.
Iegūšana
[labot šo sadaļu | labot pirmkodu]Iegūst galvenokārt no akmeņogļu darvas, koksa gāzes un darvas ūdeņiem. Piridīna atvasinājumus var iegūt, noārdot daudzus dabas produktus.
Piridīna atvasinājumus laboratoriski iegūst Hanča sintēzē - β-dikarbonilsavienojumu reakcijā ar amonjaku un aldehīdiem. Oksidējot radušos 1,4-dihidropiridīna atvasinājumus, iegūst piridīna atvasinājumus.
Var sintezēt no acetaldehīda, formaldehīda un amonjaka (sk. Čičibabina piridīna sintēze):
- CH2O + NH3 + 2 CH3CHO → C5H5N + 3 H2O + H2
Augstā temperatūrā katalizatoru (alumīnija oksīda) klātienē reaģējot aldehīdiem ar amonjaku, notiek dažādas aldolās kondensācijas, imīnu veidošanās, dehidratācijas un dehidrogenēšanas reakcijas, kas noved pie ciklizācijas un piridīna atvasinājumu veidošanās.
Piridīnu var sintezēt tieši no acetilēna un ciānūdeņraža (šī reakcija analoģiska benzola sintēzei no acetilēna).
Īpašības
[labot šo sadaļu | labot pirmkodu]Piridīna īpašības līdzīgas trešējo amīnu īpašībām - tas veido N-oksīdus un N-alkilpiridīnija sāļus. Kompleksos savienojumos piridīns var būt ligands (σ-donors).
Vienlaicīgi piridīnam piemīt aromātisko savienojumu raksturīgās īpašības - tas iesaistās nukleofilās aizvietošanas reakcijās (galvenokārt orto-pozīcijā). Tā reaģētspēja apmēram līdzīga nitrobenzola reaģētspējai.
Elektrofilās aizvietošanas reakcijās piridīns reaģē visai neaktīvi un meta-pozīcijā. Tas izskaidrojams ar elektronu sadalījuma izmaiņām piridīna gredzenā slāpekļa atoma klātbūtnes dēļ.

Piridīna gredzens ir ļoti stabils un neoksidējas ne ar CrO3, ne KMnO4.
Piridīns ir indīga viela, kas iedarbojas uz ādu un nervu sistēmu! |
Izmantošana
[labot šo sadaļu | labot pirmkodu]Lieto krāsvielu, medikamentu, insekticīdu sintēzei, piperidīna un aminopiridīna iegūšanai, kā reaģentu analītiskajā ķīmijā. Izmanto spirta denaturēšanai. Piridīns ir labs organisks šķīdinātājs.
Literatūra
[labot šo sadaļu | labot pirmkodu]- O. Neilands. Organiskā ķīmija. Rīga: Zvaigzne, 1977, 712.-718. lpp.
Ārējās saites
[labot šo sadaļu | labot pirmkodu] Vikikrātuvē par šo tēmu ir pieejami multivides faili. Skatīt: Piridīns.
Vikikrātuvē par šo tēmu ir pieejami multivides faili. Skatīt: Piridīns.
- Encyclopædia Britannica raksts (angliski)
- Krievijas Lielās enciklopēdijas raksts (krieviski)
- Encyclopædia Universalis raksts (franciski)
| Hetero- atomi |
Trīslocekļu cikli | Četrlocekļu cikli | Pieclocekļu cikli | Sešlocekļu cikli | Septiņlocekļu cikli | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| Piesātinātie | Ne- piesātinātie |
Piesātinātie | Ne- piesātinātie |
Piesātinātie | Ne- piesātinātie |
Piesātinātie | Ne- piesātinātie |
Piesātinātie | Ne- piesātinātie | |
| O | Oksirāns | Oksirēns | Oksetāns | Oksets | Tetrahidrofurāns | Furāns | Tetrahidropirāns | Pirāns | Oksepāns | Oksepīns |
| S | Tiirāns | Tiirēns | Tietāns | Tiets | Tetrahidrotiofēns | Tiofēns | Tiāns | Tiīns | Tiepāns | Tiepīns |
| N | Aziridīns | Azirīns | Azetidīns | Azets | Pirolidīns | Pirols Pirolīns Indols*** Karbazols**** |
Piperidīns Hinuklidīns* |
Piridīns Hinolīns*** Izohinolīns*** Akridīns**** |
Azepāns | Azepīns |
| 2O | Dioksetāns | Dioksolāns | Dioksāns | |||||||
| 2N | Diazets | Pirazolidīns Imidazolidīns |
Pirazols Imidazols Pirazolīns Imidazolīns |
Piperazīns | Pirazīns Pirimidīns Piridazīns |
Diazepāns | Diazepīns | |||
| 3N | Triazols Benztriazols*** |
Triazīns | ||||||||
| 4N | Tetrazols | Tetrazīns | ||||||||
| 5N | Pentazols** | |||||||||
| S + N | Tiazolidīns | Tiazols Izotiazols |
Tiomorfolīns | Tiazīns | ||||||
| O + N | Oksaziridīns | Izoksazols Oksazols |
Morfolīns | Oksazīns | ||||||
| O + 2N | Furazāns | Oksadiazīns | ||||||||
- *divi sajūgti sešlocekļu cikli **cikls sastāv tikai no slāpekļa atomiem ***satur kondensētu benzola gredzenu ****satur 2 kondensētus benzola gredzenus
|
