Virsnieres
| Virsnieru dziedzeri | |
|---|---|
 Nieres un virsnieru dziedzeri | |
 | |
| Detaļas | |
| Sistēma | Endokrīnā sistēma |
| Vēna | Suprarenālā vēna |
| Identifikatori | |
| Latīņu | Glandula supralienalis |
| MeSH | D000311 |
| TA98 | A11.5.00.001 |
| TA2 | 3874 |
| FMA | 9604 |
| Anatomiskā terminoloģija | |
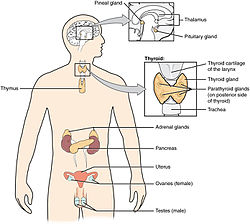
Virsnieres jeb virsnieru dziedzeri (latīņu: glandula adrenalis) ir pāra iekšējās sekrēcijas dziedzeri, kas atrodas virs nierēm un ražo dažādus hormonus, tostarp adrenalīnu un steroīdus aldosteronu un kortizolu. Virsnieres ir visiem mugurkaulniekiem, tostarp cilvēkam.
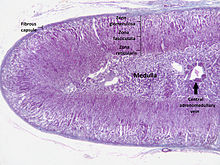
Cilvēka virsnierei izšķir serdi un garozu, kuru veido trīs slāņi. Ārējo slāni (zona glomerulosa) veido kamoliņu zona, vidējo (zona fasciculata) — pavedienu zona, iekšējo (zona reticularis) — tīklveida zona.
Virsnieru dziedzeru garozas trīs galvenie ražotie steroīdu hormoni ir kortizols, aldosterons un dzimumhormoni (androgēni un estrogēni). Minerālkortikoīdi (aldosterons un deoksikortikosterons) tiek ražoti kamoliņu zonā (zona glomerulosa) un piedalās asinsspiediena un elektrolītu regulēšanā. Pavedienu zonā (zona fasciculata) ražotie glikokortikoīdi (kortizols un kortikosterons) atbild par vielmaiņas un imūnās sistēmas regulēšanu. Tīklveida zona (zona reticularis) atbild par androgēnu veidošanu.[1] Virsnieru serdes daļā veidojas kateholamīni (adrenalīns un noradrenalīns), kas tiek pastiprināti izdalīti stresa situācijās un nepieciešami ķermeņa adaptācijai, mainoties ārējiem apstākļiem.
Virsnieres var skart dažādas endokrīnās slimības. Kortizola pārlieku liela veidošanās var novest pie Kušinga sindroma attīstības, bet samazināta veidošanās pie Adisona slimības. Virsnierēs var tikt atrasti dažādi audzēji, visbiežāk tos konstatē nejauši, radioloģiski izmeklējot citus orgānus.[2]
Uzbūve un fizioloģija
[labot šo sadaļu | labot pirmkodu]Cilvēka virsnieres veido biezāka garoza, kas ir dzeltenīga ārpusē, bet sarkanbrūna iekšpusē, un daudzkārt plānāka pelēcīga serde. Katra virsniere sver aptuveni 7—10 gramus, taču atsevišķu, ilgstošu slimību dēļ tās var palielināties. Cilvēkiem virsnieres ir 3–5 cm garas un platas, bet tikai ap 5 mm biezas.[3]
Virsnieres apņem bieza saistaudu kapsula, kurā atrodas asinsvadi, limfvadi, nervi un nervu mezgli. Virsnieres ir labi inervētas. Simpātiskās nervu sistēmas postganglionārās nemielinētās nervu šķiedras inervē garozas endokrinocītus. Preganglionārās mielinētās holīnerģiskās nervu šķiedras šķērso garozu un inervē serdes hromafīnās šūnas.[4]
Asinsapgāde
[labot šo sadaļu | labot pirmkodu]Virsnieres salīdzinoši ir vieni no visapasiņotākajiem audiem ķermenī. Virsnieres apasiņo trīs galvenās artērijas:[5]
- Augšējā virsnieres artērija (a. suprarenalis superior), kas ir apakšējās diafragmas artērijas (a. diaphragmatica/phrenica inferior) zars;
- Vidējā virsnieres artērija (a. suprarenalis media), kas atiet no aortas vēdera daļas;
- Apakšējā virsnieres artērija (a. suprarenalis inferior), kas ir nieres artērijas (a. renalis) zars.
Šie asinsvadi sazarojas mazās artērijās, kas caurvij virsnieru kapsulu. No kapsulas savukārt atiet saistaudu pavedieni ar mazākiem asinsvadiem, kas apasiņo dziedzerus.
Venozās asinis aizplūst pa virsnieres vēnām:
- Labā virsnieres vēna ieplūst v. cava inferior.
- Kreisā virsnieres vēna ieplūst kreisajā nieres vai kreisajā diafragmālajā vēnā.

Garoza
[labot šo sadaļu | labot pirmkodu]Zem virsnieres kapsulas ir biezs garozas slānis (80% no tilpuma).
Garozā (cortex) izšķir trīs zonas: ārējo jeb kamoliņu zonu, vidējo jeb pavedienu zonu, iekšējo jeb tīklveida zonu.
Ārējā zona
[labot šo sadaļu | labot pirmkodu]Ārējā jeb kamoliņu zonā (zona glomerulosa) atrodas sīkas šūnas, kas sagrupētas pavedienos un veido kamoliņus. Kamoliņus veido sīkas cilindriskās vai piramidālās šūnas ar apaļiem kodoliem. Šīs šūnas savā starpā veido komunikācijas (spraugveida) kontaktus. Starp šiem blīvi izvietotajiem kamoliņiem ir plānas saistaudu josliņas jeb septas, kas veido tīklveida balstu (stromu) dziedzera audiem. Septās ir artērijas, sinusoīdi ar fenestrēto endotēliju un nervi.
Funkcijas
[labot šo sadaļu | labot pirmkodu]Ārējās zonas šūnas sekretē minerālkortikoīdus, regulējot nātrija, kālija un ūdens homeostāzi organismā. Piemēram, aldosterons ietekmē distālos nefrona kanāliņus, kuņģa gļotādu, sviedru un siekalu dziedzerus, veicinot kālija izdalīšanu, nātrija reabsorbciju.[4][7]
Vidējā zona
[labot šo sadaļu | labot pirmkodu]Vidējā jeb pavedienu zonā (zona fasciculata) atrodas lielo poligonālo šūnu veidotie taisnie pavedieni (1—2 šūnu rindas), kuri novietoti perpendikulāri serdei.
Starp pavedieniem stiepjas septas, kas uzskatāmas par ārējās zonas septu turpinājumu. Šos endokrinocītus sauc arī par spongiocītiem.[8] To mitohondrijos ir tubulārās kristas, daudz tauku ieslēgumu (holesterīns, fosfolipīdi, taukskābes), no kā tiek veidoti steroīdhormoni. Uz robežas starp kamoliņu zonu un pavedienu zonu endokrinocītu pavedieni satur cilmes šūnas.
Funkcijas
[labot šo sadaļu | labot pirmkodu]Vidējā zona sekretē glikokortikoīdus (nedaudz arī gonadokortikoīdus). Viens no tiem ir kortizols. Kortizola ietekme uz vielmaiņu izpaužas šādi:
- paaugstina glikozes, taukskābju līmeni asinīs;
- kavē olbaltumvielu sintēzi, un tā rezultātā aminoskābes var tikt izmantotas glikoneoģenēzē;
- veicina glikogēna sintēzi hepatocītos, kā arī sirds un skeleta muskuļaudos;
- kortizola ietekmē asinīs no taukšūnām atbrīvojas taukskābes.
Citi glikokortikoīdi ir kortikosterons un kortizons. Glikokortikoīdi samazina iekaisuma procesus, palēnina limfoblastu mitozi. Savas antiproliferatīvās darbības dēļ tie palēnina dzīšanu.[9]
Adrenokortikotropais hormons no adenohipofīzes regulē glikokortikoīdu sekrēciju un sintēzi. Adrenokortikotropais hormons ir nepieciešams šūnu augšanai, stimulē steroīdu sintēzi un palielina asins caurplūdi šai zonai.[4][7]
Dziļā zona
[labot šo sadaļu | labot pirmkodu]Dziļajā zonā (zona reticularis) endokrinocīti ir mazāki nekā pavedienu zonas endokrinocīti. Izšķir gaišās šūnas un tumšās šūnas. Tumšās šūnas satur vairāk pigmenta lipofuscīna ieslēgumu un histoloģiski labi krāsojas. Raksturīgas steroīdsintezējošas šūnu uzbūves īpašības — vājš graudainais endoplazmatiskais tīkls un mitohondriji ar tubulārām kristām. Steroīdu hormoni neuzkrājas sekretorajās granulās, bet pēc sintēzes nekavējoties izdalās no šūnas.
Funkcijas
[labot šo sadaļu | labot pirmkodu]Tās sintezē vājus androgēnus — dehidroepiandrosteronu (DHEA) un androstendiolu. Citos audos šie hormoni var pārvērsties par aktīvu androgēnu — testosteronu vai arī par estrogēniem. Sievietēm virsnieres ir galvenais androgēnu avots, tādēļ pubertātes periodā parādās, piemēram, padušu un kaunuma apmatojums. Turklāt androgēni veicina muskulatūras masas palielināšanos. Organismam novecojot, DHEA sintēze samazinās.[4][7][8][10]
Serde
[labot šo sadaļu | labot pirmkodu]Serdi (medulla) no visām pusēm apņem garoza. Tajā atrodas lielas hromafīnās šūnas, kas izkārtotas pavedienos. Tās pēc izcelsmes ir modificēti neironi. Izpētīts, ka audu kultūrās tās veido aksoniem līdzīgus izaugumus. Aptuveni 20% noradrenalīna (norepinefrīns) un 80% adrenalīna (epinefrīns) tiek izdalīts serdē.[11]
Funkcijas
[labot šo sadaļu | labot pirmkodu]Stresa situācijās, pienākot impulsam pa preganglionārajām mielinētajām holīnerģiskajām šķiedrām, šūnas izdala sintezētos kateholamīnus. Izšķir 2 šūnu tipus, atkarībā no tā, ko tās sekretē.
- Viens šūnu tips (lielākā daļa) sekretē adrenalīnu. To sekretorās granulas ir mazākas un ar gaišāku serdi. Adrenalīns, stimulējot beta adrenerģiskos receptorus, paātrina un pastiprina sirdsdarbību, paaugstina vielmaiņu un glikozes līmeni asinīs, kā arī izraisa bronhu un skeleta muskulatūras asinsvadu gludo miocītu atslābumu. Adrenalīna izraisītie efekti ir plaši, kas ir noderīgi smaga stresa situācijās, piemēram, asu sāpju gadījumā.
- Otrs šūnu tips veido noradrenalīnu. Tajās ir lielas sekretorās granulas ar tumšu serdi un gaišu apmali. Noradrenalīns ietekmē galvenokārt alfa adrenerģiskos receptorus un izraisa, piemēram, perifēro asinsvadu gludo miocītu saraušanos, tādējādi paaugstinot asinsspiedienu. Noradrenalīns izdalās neliela stresa situācijās, piemēram, psihoemocionālā stresa gadījumā.
Kateholamīni veicina arī lipolīzi, kuras rezultātā asinīs no tauku šūnām atbrīvojas taukskābes.[4][7][8]
Virsnieru dziedzeru slimības
[labot šo sadaļu | labot pirmkodu]Virsnieru normāla darbība var tikt traucēta dažādu iemeslu dēļ, piemēram, infekciju, audzēju, ģenētisko, autoimūno slimību rezultātā. Šie traucējumi var skart gan virsnieru struktūras (autoimūno slimību gadījumā), kā arī izdalīto hormonu daudzumu (Kušinga sindroma gadījumā).
Kortikosteroīdu pārprodukcija
[labot šo sadaļu | labot pirmkodu]Kušinga sindroms
[labot šo sadaļu | labot pirmkodu]Kušinga sindroms ir simptomu un pazīmju kopums, kas radies ilgstoši paaugstināta hormona kortizola līmeņa dēļ. Biežākie simptomi ir vēdera aptaukošanās, tievi locekļi, apaļa seja, vāji muskuļi un kauli, pinnes, strijas u. c. pazīmes.
Tas var rasties gan paildzinātas glikokortikoīdu lietošanas gadījumos, gan arī, ja tiek skarta hipotalāma-hipofīzes ass un pastiprināti veidojas kortizols. Pēdējā gadījumā izšķir AKTH (adrenokortikotropā hormona) — atkarīgos un AKTH — neatkarīgos iemeslus. Visbiežākais Kušinga sindroma iemesls ir hipofīzes adenoma, kad pastiprināti veidojas AKTH un tiek stimulētas virsnieres.
Primārais aldosteronisms
[labot šo sadaļu | labot pirmkodu]Primārais aldosteronisms veidojas, ja kamoliņu zona ražo pārlieku daudz aldosterona. Biežākie iemesli ir aldestoronu producējošās adenomas (Kona sindroms), kā arī bilaterāla (abpusēja) virsnieru hiperplāzija. Primārais aldosteronisms izraisa jonu disbalansu un paaugstinātu asinsspiedienu.
Virsnieru mazspēja
[labot šo sadaļu | labot pirmkodu]Virsnieru mazspēja jeb samazināta spēja veidot glikokortikoīdus ir sastopama 5 cilvēkiem no 10 000.[12] Pie primārām virsnieru slimībām pieder Adisona slimība un ģenētiskās slimības, kad tiek skarta tieši virsnieru struktūra. Ja bojājums ir hipotalāma-hipofīzes ass regulējošā sistēmā, tad tā ir sekundāra virsnieru mazspēja.
Adisona slimība
[labot šo sadaļu | labot pirmkodu]
Adisona slimībai raksturīgs glikokortikoīdu un minerālkortikoīdu trūkums. Rietumu pasaulē Adisona slimību lielākoties izraisa autoimūnas slimības, taču citur tā visbiežāk rodas infekciju, sevišķi tuberkulozes gadījumā. Adisona slimībai raksturīga ādas hiperpigmentācija un citi nespecifiski simptomi, piemēram, nogurums. Neārstējot Adisona slimību, glikokortikoīdu un minerālkortikoīdu trūkums var novest pie hipovolēmiskiem simptomiem, vemšanas, drudža un komas. Krīžu laikā tiek lietotas hidrokortizona injekcijas.[13]
Sekundārā nieru mazspēja
[labot šo sadaļu | labot pirmkodu]Ja tiek bojāta hipotalāma-hipofīzes ass regulējošā sistēma, tad attīstās sekundāra virsnieru mazspēja. Šīs mazspējas gadījumā netiek skarta minerālkortikoīdu veidošanās, jo to regulē renīna-angiotenzīna sistēma, nevis hipofīzes ražotais AKTH.[1]
Virsnieru audzēji
[labot šo sadaļu | labot pirmkodu]Virsnieru audzēji lielākoties tiek atklāti kā incidentalomas — asimptomātiski audzēji, kas atrasti radioloģisko izmeklējumu laikā. Tās tiek atrastas aptuveni 3% datortomogrāfijas izmeklējumu gadījumos un lielākoties tās ir labdabīgas adenomas. Ļaundabīgais audzējs — virsnieru karcinoma ir reta slimība, kuras sastopamības biežums ASV ir divi gadījumi uz vienu miljonu iedzīvotāju gadā. Novērots, ka virsnieru karcinoma izpaužas dzīves pirmajā un ceturtajā desmitgadē, turklāt bērniem pēc ķirurģiskas ārstēšanas ir labāka prognoze.[3]
Feohromocitoma ir neiroendokrīns kateholamīnus producējošs audzējs, kas veidojas no hromafīnajām šūnām. Tās var radīt dažādus nespecifiskus simptomus, piemēram, galvassāpes, svīšanu, uztraukumu, paātrinātu sirdsdarbību un paaugstinātu asinsspiedienu.[14]
Vēsture
[labot šo sadaļu | labot pirmkodu]Cilvēka virsnieru uzbūvi pirmo reizi aprakstīja Bartolomeo Eistahijs 1563.—1564. gadā, taču šie apraksti atradās Vatikāna bibliotēkā un ilgu laiku tā arī nenonāca līdz sabiedrībai. Tikai 1611. gadā K. Bartolīni tos izmantoja, lai ilustrētu virsnieres.[15] Virsnieru mazspējas klīnisko ainu 1855. gadā aprakstīja Tomass Adisons.[16] 1866. gadā Frenkels pirmo reizi aprakstīja virsnieru audzēju, ko mūsdienās sauc par feohromocitomu. 1932. gadā Viljams Kušings aprakstīja sindromu, kurš tagad ir nosaukts viņa vārdā — Kušinga sindroms.[3]
Atsauces
[labot šo sadaļu | labot pirmkodu]- ↑ 1,0 1,1 Melmed, S; Polonsky, KS; Larsen, PR; Kronenberg, HM (2011). Williams Textbook of Endocrinology(12th ed.). Saunders. ISBN 978-1437703245.
- ↑ Nieman, LK (2010). "Approach to the patient with an adrenal incidentaloma.". The Journal of Clinical Endocrinology and Metabolism 95(9): 4106—13. doi:10.1210/jc.2010-0457. PMC 2936073.PMID 20823463.
- ↑ 3,0 3,1 3,2 Jānis Gardovskis, Ralfs Kolītis, Jāzeps Baško, Antoņina Sondore u. c. Ķirurģija. Rīga : Rīgas Stradiņa universitāte, 2013. 1013. lpp. ISBN 978-9984-793-28-3.
- ↑ 4,0 4,1 4,2 4,3 4,4 Aina Dālmane. Histoloģija. Rīga : LU Akadēmiskais apgāds, 2004. 319. lpp. ISBN 9984-770-42-7.
- ↑ Thomas, edited by Paul; Molecular, School of; Australia, Biomedical Science, University of Adelaide, Adelaide, South Australia, (2013). Endocrine Gland Development and Disease. Burlington: Elsevier Science. p. 241.ISBN 9780123914545.
- ↑ «OpenStax CNX». cnx.org. Skatīts: 2015-08-01.
- ↑ 7,0 7,1 7,2 7,3 Ross M, Pawlina W (2011). Histology: A Text and Atlas (6th ed.). Lippincott Williams & Wilkins. p. 780. ISBN 978-0-7817-7200-6.
- ↑ 8,0 8,1 8,2 Jurijs Markovs. Medicīniskā histoloģija II. Rīga : SIA J.T. Group, 2005. 212. lpp. ISBN 978-9984-716-76-3.
- ↑ Agnis Štifts. «Glikokortikoīdi terapijā. Vēlreiz par 50 gadu senu tēmu.», 2002. Arhivēts no oriģināla, laiks: 2016. gada 4. martā. Skatīts: 2015. gada 1. novembrī.
- ↑ Young B, Woodford P, O'Dowd G (2013). Wheater's Functional Histology: A Text and Colour Atlas (6th ed.). Elsevier. p. 329. ISBN 978-0702047473.
- ↑ Dunn R. B., Kudrath W., Passo S.S., Wilson L.B. «10». Kaplan USMLE Step 1 Physiology Lecture Notes, 2011. 263–289. lpp.
- ↑ Longo, D; Fauci, A; Kasper, D; Hauser, S; Jameson, J; Loscalzo, J (2012). Harrison's Principles of Internal Medicine(18th ed.). New York: McGraw-Hill. ISBN 978-0071748896.
- ↑ Hydrocortisone Emergency Factsheet for Ambulance Personnel Arhivēts 2015. gada 24. septembrī, Wayback Machine vietnē. The Pituitary Foundation
- ↑ Martucci, VL; Pacak, K (2014). "Pheochromocytoma and paraganglioma: diagnosis, genetics, management, and treatment.". Current Problems in Cancer 38 (1): 7—41. doi:10.1016/j.currproblcancer.2014.01.001. PMC 3992879.PMID 24636754.
- ↑ O'Hare, A. Munro Neville, Michael J. (2012). The Human Adrenal Cortex Pathology and Biology — An Integrated Approach. London: Springer London. pp. Chapter 2: Historical Aspects. ISBN 1447113179.
- ↑ Pearce, JM (2004). "Thomas Addison (1793—1860)". Journal of the Royal Society of Medicine 97 (6): 297—300.doi:10.1258/jrsm.97.6.297. PMC 1079500.PMID 15173338.
| ||||||||||||||||||||||||||||||
|
