Spirti


Spirti ir ogļūdeņražu hidroksilatvasinājumi, kam viens vai vairāki (vairākvērtīgajiem spirtiem) ūdeņraža atomi ir aizvietoti ar hidroksilgrupām (−OH). Spirtu molekulās hidroksilgrupa ir pie sp3 hibridizēta oglekļa atoma[1] (kā piesātinātos ogļūdeņražos; t.i. bez dubultsaitēm vai trīskāršajām saitēm). Vienkāršāko piesātināto spirtu jeb alkanolu vispārējā formula ir CnH2n+1OH. Ļoti bieži ar jēdzienu 'spirts' saprot etanolu jeb etilspirtu. Spirti parasti ir stabilas vielas.
Var būt arī tādi spirti, kas bez hidroksilgrupas satur citas funkcionālās grupas (aminogrupas, aldehīdgrupas u.c.). Tos sauc par aminospirtiem, aldehīdspirtiem, ketospirtiem utt. Ja bez hidroksilgrupas vielas molekulā ir karboksilgrupa, tad vielu sauc par hidroksikarbonskābi un pieskaita organiskajām skābēm, nevis spirtiem. Spirtu molekulas var saturēt halogēnu atomus vai heterocikliskus grupējumus.
Dažreiz spirtus dēvē novecojušā nosaukumā par alkoholiem.
Spirtu atrašanās dabā un ieguve no dabas produktiem[labot šo sadaļu | labot pirmkodu]
Hidroksilgrupas saturoši savienojumi ir plaši izplatīti dabā. Ogļhidrāti ir uzskatāmi par daudzvērtīgiem aldehīdspirtiem vai ketospirtiem. To polimēri veido lielu daļu no augu ķermeņa. Daudzi ogļhidrāti ir svarīgas visu dzīvo organismu sastāvdaļas (riboze un dezoksiriboze ir nukleīnskābju sastāvā). Arī daudzvērtīgie spirti, kas atvasināti no cukuriem, dabā ir plaši sastopami (sorbīts, mannīts). Starp olbaltumvielas veidojošajām aminoskābēm ir arī hidroksilatvasinājums serīns. Spirts holesterīns ir labi pazīstama lipīdu sastāvdaļa. Neiromediatora acetilholīna avots organismā ir holīns — aminospirta atvasinājums. Konjugētais alilspirts retinols piedalās acu gaismjutīgā pigmenta rodopsīna sintēzē. Dažu kukaiņu (piemēram, zīdtauriņu) feromoni ir sarežģīti spirti. No dažādiem spirtiem (koniferilspirts u.c.) un to atvasinājumiem veidojas lignīna sarežģītās molekulas.
Daudzus spirtus satur ziedu ēteriskās eļļas (geraniols, citronelols un linalools), daļa terpenoīdu ir spirti (borneols, fenhols, mentols). Latvāņi satur nedaudz metanola.[2]
Etanolu bieži iegūst spirta raudzēšanas procesā no ogļhidrātus bagātīgā daudzumā saturošiem dabas produktiem. Metanolu agrāk rūpnieciski ieguva koksnes sausajā pārtvaicē.
Spirtu iedalījums[labot šo sadaļu | labot pirmkodu]
Spirtus var uzskatīt par alkilhidroksiatvasinājumiem, kur ogļūdeņraža molekulā pie kāda no oglekļa atomiem pievienota hidroksilgrupa −OH. Atkarībā no tā, cik neaizvietotu ūdeņraža atomu ir pie oglekļa atoma, ar kuru saistīta hidroksilgrupa, spirtus iedala
- pirmējos (2 neaizvietoti H atomi);
- otrējos (1 neaizvietots H atoms);
- trešējos (nav neaizvietotu H atomu).
Oksidējot (dehidrogenējot) pirmējos spirtus, var iegūt aldehīdus, šī reakcija notiek relatīvi viegli, salīdzinot ar otrējo spirtu oksidēšanos, kur iegūst ketonus. Oksidējot trešējos spirtus, var iegūt tikai karbonskābju maisījumu, un šī reakcija notiek tikai ļoti agresīvos apstākļos.
Spirtu molekulās var būt viena vai vairākas hidroksilgrupas. Hidroksilgrupas parasti ir pie dažādiem oglekļa atomiem, jo savienojumi, kam pie viena oglekļa atoma pievienotas divas hidroksilgrupas, — geminālie dioli — ir nestabili (atšķeļ ūdeni un pārvēršas par ketoniem). Izņēmums ir gadījumi, kad pie šāda oglekļa atoma ir stipri elektronu akceptori (hlorāls hidratējas par hlorālhidrātu, indāntrions (zemāk) – par ninhidrīnu). Geminālo diolu veidotie ēteri ir stabili (acetāli un ketāli).

Geminālie trioli dehidratējas par karbonskābēm (šādus spirtus sauc arī par ortokarbonskābēm, analoģiski kā neorganiskajā ķīmijā), taču pazīstami to ēteri, kurus dēvē par karbonskābju ortoesteriem.
Atkarībā no pārējās struktūras (neapskatot to C atomu, pie kura ir OH grupa) mēdz būt šāds spirtu iedalījums:
- ja spirta molekulā ir tikai vienkāršās saites, tos mēdz dēvēt par alkanoliem (metanols, glicerīns);
- ja atlikumā ir C=C dubultsaite – par alkenoliem (alilspirts, geraniols);
- ja trīskāršā saite C≡C, tad par alkinoliem (propargilspirts);
- ja aizvietotājs ir ciklisks, spirtus dēvē par cikloalkanoliem vai cikloalkenoliem (cikloheksanols, borneols – bicikloalkanols jeb spirts, kas atvasināts no bicikloalkāna);
- ja aromātiskie aizvietotāji – par arenoliem (benzilspirts, trifenilmetanols).
Spirtus, kuriem ogļūdeņraža atlikums ir taisns, nesazarots, dēvē (tāpat kā visas pārējās organiskās vielas) par normālajiem. Spirtus ar ļoti gariem, galvenokārt nesazarotiem ogļūdeņraža atlikumiem mēdz saukt par augstākajiem vai taukskābju spirtiem, jo tos var iegūt, reducējot taukskābes.
Atbilstoši hidroksilgrupu skaitam molekulā, spirta nosaukuma izskaņa ir:
- -ols (1 −OH grupa);
- -diols (2 −OH grupas);
- -triols (3 −OH grupas).
Spirtus, kuru molekulās ir vairāk par trim −OH grupām, sauc par daudzvērtīgajiem spirtiem jeb polioliem.
Spirtu fizikālās īpašības[labot šo sadaļu | labot pirmkodu]

Spirta grupa C—OH parasti absorbē elektromagnētisko starojumu pie viļņa garuma apmēram 170–180 nm, tādēļ šīs vielas ir bezkrāsainas. Turklāt, šis viļņa garums attiecas jau uz vakuuma UV spektra daļu. Spirta grupa tādēļ nav hromofors, bet tiek pieskaitīta auksohromiem, jo padziļina krāsu, ja atrodas konjugācijā ar hromoforām grupām.[3] Ūdens absorbcijas maksimums ir pie 167 nm; dialkilēteriem tas ir pie 185–190 nm, un te parādās alkilgrupu vājās donora īpašības.[1] Pārejai ir n→σ* tips pēc Kašas klasifikācijas.[3]
Infrasarkanajā spektrālajā rajonā alkanoli absorbē "pirkstu nospiedumu" rajonā (1000–1200 cm−1), kas ietrāpa C–C absorbcijas joslā; pirmējiem un otrējiem spirtiem ir divas vājas (pirmējiem) vai vidēji stipras (otrējiem) absorbcijas joslas aptuveni pie 1350 un 1400 cm−1. Šīs joslas attiecas uz O—H saites deformācijām.[3] Spirtu raksturīgās frekvences ir 3500–3700 cm−1, kur novērojama brīvās O–H saites absorbcija; ja šī grupa veido ūdeņraža saiti, tad saite ir iesvārstāma vieglāk (pie 3100–3500 cm−1). Ūdeņraža saites veidošanos novēro koncentrētos spirtu šķīdumos, kā arī, ja klāt ir H saites akceptora viela (Lūisa bāze).[4] Visas minētās svārstības nav aktīvas kombinētās izkliedes (Ramana) spektros.[3]
Etanolā saites garums C—C ir 1,54 Å, C—O – 1,44 Å, bet O—H ir 0,97 Å gara.[1] Dipolmoments saitei O—H spirtos ir 1,51 debaji, C—O saitei spirtos 1,1 D (ja saitei C—H pieņem "apgrieztu" pēc klasiskiem uzskatiem polaritāti, kā iegūts dažos darbos, tad C—O dipolmoments ir 1,9 D). OH grupas refrakcija (pēc Fogeļa) nātrija D līnijai ir 2,546. Saites O—H refrakcija (tāpat pēc Fogeļa) ir 1,66, tas ir nedaudz mazāk nekā C—H saitei (1,676), mazāk nekā N—H (1,76) un ievērojami mazāk nekā S—H saitei (4,80), taču vairāk nekā C—O saitei (1,54 ēteros un 1,46 acetālos).[3] Tas ir aptuvens rādītājs tam, ka O—H saite nav īpaši polarizējama – kas neizbrīna, jo skābeklis ir ļoti elektronegatīvs elements, turklāt O atoms ir izmēros neliels un saites ar H elektroni ir izvietoti visai kompakti.
1H KMR spektrā spirtiem parasti ir plats signāls pie 0,5–5 m. d.[5] (biežāk pie 1 līdz 2 m. d.), jo tie atrodas intensīvā ķīmiskā apmaiņā ar ūdeni paraugā (spirti parasti ir higroskopiski, un ūdens tvaiki no gaisa izšķīst paraugā). Signāls pazūd, ja paraugam pievieno D2O. Jo lielāka ir spirta koncentrācija, jo vājākos laukos nobīdās OH protona signāls (līdz 5 m. d. tīram etanolam), un bez ūdens klātbūtnes tā līnijas ir asas (novērojama arī spinu sadarbības izraisītā šķelšanās multipletā). Parasti gan signāls ir ļoti plats ķīmiskās apmaiņas dēļ, ko veicina skābju klātbūtne (kā ir CDCl3 šķīdumā) un kavē ūdeņraža saites ar aprotisku šķīdinātāju (kā DMSO-d6, kurā hidroksilgrupas protona signāls ir labi redzams ar visu spinu sadarbību). Pusacetāla O–H protona signāls (piemēram, cukuros) ir redzams vēl vājākos laukos, virs 6,5 m. d. 13C KMR spektrā C atoma signālu, pie kura atrodas hidroksilgrupa, novēro parasti pie 50–70 m. d.[6]
Spirti parastajos apstākļos ir šķidras vai kristāliskās vielas. Tabulā apkopotas dažu spirtu kušanas temperatūras salīdzinājumā ar alkāniem.
| C atomu skaits molekulā | Alkāni | Normālie vienvērtīgie spirti | Daudzvērtīgie spirti (CnHn+2(OH)n) |
|---|---|---|---|
| 1 | –182,5 | –97,0 | – |
| 2 | –183,3 | –114,1 | –12 |
| 3 | –187,6 | –127 | 20 |
| 4 | –138,4 | –80 | 118 (eritrīts), 87 (treīts) [7] |
| 5 | –129,7 | –78,8 | 366 (ksilīts), 379 (D-arabinīts) [7] |
| 6 | –95,3 | –51,6 | 372 (sorbīts, stabilākā forma), 439 (D-mannīts) [7] |
| 7 | –90,6 | –34,1 | |
| 8 | –56,8 | –18 | |
| 9 | –53,6 | –5 | |
| 10 | –30,3 | +7 | |
| 15 | +10 | +45 | |
| 16 | +18,1 | +50 |
Homologu rindas sākumā kušanas temperatūra krītas, jo molekulā parādās atšķirīgas polaritātes rajoni. Pēc tam pārsvaru gūst molekulmasas pieaugums, un kušanas temperatūra sāk pieaugt. Gandrīz nav novērojamas alkāniem raksturīgās Tkuš = f(nC) kušanas temperatūras svārstības ar mazākiem pieaugumiem pie papildu atoma ievadīšanas pāra atomu skaita molekulā, ko izraisa iegūto molekulu pakojuma relatīvi mazāks izdevīgums šajā gadījumā. Vislielākās atšķirības attiecībā pret alkāniem ir, protams, daudz augstākas kušanas temperatūras, lai arī spirtu molekulmasa ir daudz zemāka – tāpat kā viršanas temperatūru gadījumā, arī šeit to izraisa ūdeņraža saišu klātbūtne kristālā. Daudzvērtīgiem spirtiem CnHn+2(OH)n kušanas temperatūras tādēļ ir vēl augstākas, turklāt ļoti ievērojami, jo molekulā nav nepolāru centru.[nepieciešama atsauce] Kā parasti, ievadot virknē sānu grupas, kušanas temperatūra pazeminās,[3] jo molekulām ir grūtāk sakārtoties kristālā (izņemot gadījumu, ja visi pamatvirknes oglekļi ir kvartāri, bet visi aizvietotāji ir metilgrupas[3]).
Viršanas temperatūras spirtiem ūdeņraža saišu veidošanās dēļ ir daudz augstākas nekā atbilstošiem jodalkāniem, lai arī spirtu molekulas ir daudz vieglākas; kušanas temperatūras nav tik ekstremālas un zemākajiem rindas pārstāvjiem ir nedaudz lielākas nekā bromalkāniem.[1] Homologu rindas ietvaros gan novēro Tvirš pieaugumu līdz ar molekulmasas palielināšanos.
| C atomu skaits molekulā | Alkāni | Normālie vienvērtīgie spirti | Normālie metilēteri |
|---|---|---|---|
| 1 | –161,6 | +64,7 | –23,6 |
| 2 | –88,6 | +78,3 | +7,5 |
| 3 | –42,2 | +97,2 | +39,9 |
| 4 | –0,5 | +117,7 | +70,3 |
| 5 | +36,1 | +138 | +88,5 |
| 6 | +68,8 | +157,2 | +126,1 [7] |
| 7 | +98,4 | +176,3 | |
| 8 | +125,7 | +194,5 | |
| 9 | +149,5 | +213 | |
| 10 | +173,0 | +231 |
Īpaši spilgti ūdeņraža saites ietekme parādās salīdzinājumā ar metilēteriem, kuri, lai arī smagāki par 14 daltoniem, virst daudz zemākā temperatūrā nekā attiecīgie spirti. Neskatoties uz to, ēteri ir polārāki par alkāniem, tādēļ vārās pie ievērojami lielākas temperatūras. Jo lielāks ir ogļūdeņraža atlikums, jo mazāka ir viršanas temperatūras starpība spirtam un attiecīgajam alkānam vai ēterim. Ja virkne ir sazarota, viršanas temperatūra, kā jau ir nojaušams, krītas.[3]
Ūdeņraža saites izraisītā spirtu asociācija uzskatāmi parādīta zemāk.

Zemākajiem spirtiem (līdz propanolam ieskaitot) piemīt patīkama, saldena smarža; tāpat arī augstākajiem spirtiem, bet izopropanolam, butanolam, pentanolam un tiem tuviem alkanoliem smarža ir nepatīkama;[1] tie veido sīveļļas pārtikas etanola ražošanas procesā.
Spirtu iegūšana[labot šo sadaļu | labot pirmkodu]
- Halogēnatvasinājumu hidrolīze
- Halogēnogļūdeņraži ar saiti C(sp3)–Hal viegli hidrolizējas ūdens vidē vai sārma šķīdumā. Reakcija notiek gan pēc SN1, gan pēc SN2 mehānisma (atkarībā no savienojuma struktūras mainās konkurējošo procesu īpatsvars).[8]
- Sārms nedrīkst būt pārāk koncentrēts, lai nenotiktu ūdens atšķelšanās un neveidotos dubultsaite (ja tāda iespēja pastāv, protams, – gadījumos, ja pie α oglekļa ir ūdeņraža atoms). Īpaši tas ir raksturīgs trešējiem alkilhalogenīdiem, kā arī sildot. Lai halogēnūdeņradis neatšķeltos, parasti šķīdumam pievieno sārmzemju metāla karbonātus, PbO vai Ag2O, un tad reakcijas maisījumu var pat vārīt. Vēl izdevīgāk ir sākumā pārvērst halogēnatvasinājumu esterī ar CH3COOAg, jo acetātanjons ir labs nukleofils, bet vāja bāze, un nesekmē alkēnu veidošanos. Iegūto alkilacetātu uzmanīgi hidrolizē un iegūst spirtu bez alkēna piemaisījuma.[9]
- Viegli hidrolizējas alilhalogenīdi, kam ir izdevīgi veidot alilkatjonu.
- Esteru hidrolīze (pārziepjošana)
- Reakcija ir pretējs process esterifikācijai, to izmanto dažādu, tostarp augstāko, spirtu iegūšanai no dabā sastopamiem esteriem (ēteriskajām eļļām, vaskiem, taukiem).[10]
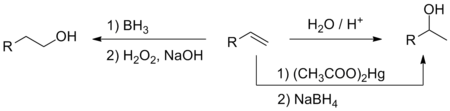
- Ūdens pievienošana alkēniem
- Alkēni skābu katalizatoru (sērskābe, fosforskābe, ar skābi apstrādāts Al2O3 katalizators) klātbūtnē pievieno ūdeni un pārtop par spirtiem. Sākumā pievienojas protons, tad otram dubultsaites ogleklim uzbrūk ūdens molekula. Izveidojies oksonija jons deprotonējas, atgriežot katalizatoru (H+) vidē. Tā kā reakcijas norise saistās ar karbkatjoniem kā starpproduktiem, pievienošana pakļaujas Markovņikova likumībai (hidroksilgrupa pievienojas pie oglekļa, kas ir visvairāk aizvietots).
- Taču šī pievienošanās ir atkarīga no aizvietotājiem alkēna virknē; ja tie ir stipri elektronakceptori, var veidoties arī pirmējais spirts.[11]
- Hidratācija var norisēt pēc diviem mehānismiem: tiešā un netiešā hidratācija.[11]
- Tiešajā hidratācijā ūdens tieši pievienojas alkēnam, tas notiek gāzes fāzē, paaugstinātā temperatūrā un spiedienā, iespējams, ar nelielu daudzumu katalizatora (H2SO4). Tā rūpnieciski iegūst, piemēram, izopropilspirtu no propilēna. Rūpnieciskā etilēna hidratācija ir lētākā etanola iegūšanas metode.[11]
- Netiešajā hidratācijā sākumā veidojas sērskābes esteris, kas pēc tam hidrolizējas. Šajā procesā izmanto lielas sērskābes koncentrācijas (80—90 %), arī nelielu spiedienu; temperatūra nav augsta, var būt arī istabas temperatūras līmenī. Arī šo metodi izmanto rūpniecībā.

- Ja alkilsulfātu apstrādā atkal ar spirtu, nevis ūdeni, iegūst ēterus.
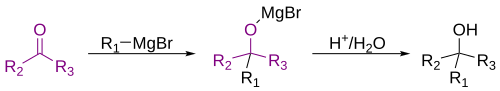
- Metālorganisko savienojumu reakcijas ar karbonilsavienojumiem
- Griņjāra (Grignard) reaģenti (magnijorganiskie savienojumi) pievienojas karbonilsavienojumiem, veidojot spirtus. No ketoniem veidojas trešējie spirti, no aldehīdiem (sākot ar CH3CHO) – otrējie, no formaldehīda – pirmējie.[8][12]
- Reakcijai ir virkne iespējamo blakusproduktu. Iegūtais trešējais spirts var viegli dehidratēties, īpaši sazarotas molekulas gadījumā (tas stabilizē karbkatjonu EN1 reakcijā). Bez tam, ja karbonilsavienojums ir spējīgs enolizēties, tas to var darīt tik stipras bāzes kā metālorganiskais savienojums gadījumā. Novērots arī, ka, ja Griņjāra reaģents satur H atomus pie β oglekļa, tie mēdz pievienoties karbonilgrupas ogleklim, tā ka veidojas galu galā otrējais spirts no ketona un pirmējais – no aldehīda. No bijušā Griņjāra reaģenta veidojas alkēns.[12]
- Analoģiskas ir reakcijas ar karbonskābēm un to dažādiem karbonskābju atvasinājumiem. Šoreiz pie karbonilfragmenta oglekļa pievienojas divi ogļūdeņraža atlikumi no metālorganiskā reaģenta. Trešējie spirti kā pamatprodukti parasti veidojas reakcijās ar karbonskābju sāļiem, halogēnanhidrīdiem, parastajiem anhidrīdiem, ar esteriem. Nitrilu gadījumā trešējie spirti tiek iegūti, ja secīgi pievienojas divi ekvivalenti metālorganiskā reaģenta un iegūtais amīns tiek hidrolizēts. Parasti šajā gadījumā tomēr rodas karbonilsavienojumi.[12]
- Metālorganisko savienojumu reakcija ar epoksīdiem
- Reakcijā notiek epoksīda cikla uzslēgšana, turklāt ogļūdeņraža virkne (kas ietilpa metālorganiskajā savienojumā) tiek pagarināta par diviem C atomiem (neskaitot aizvietotājus pie epoksīdiem).[12]
- Arēnu alkilēšana ar epoksīdu
- Lūisa skābju (Frīdela—Kraftsa katalizatoru) klātbūtnē etilēnoksīds alkilē aromātiskā ogļūdeņraža gredzenu un veido 2-aril-1-etanolu.[8][jāprecizē]
- Favorska (Фаворский) reakcijā terminālais alkīns sārmainā vidē pievieno formaldehīda vai ketona molekulu un veido propargilspirtu. Šeit spēcīgs nukleofils acetilenīdanjons uzbrūk karbonilgrupai, un veidojas alkinilalkilspirti.
- Šādā veidā rūpnieciski iegūst propargilspirtu un 2-butīn-1,4-diolu (katalizators ir vara acetilenīds, reakcija noris zem spiediena). Minētajam diolam ir plašs rūpniecisks pielietojums (dažādi monomēri, THF sintēze utt.).[8]
Dažādas reducēšanas reakcijas[labot šo sadaļu | labot pirmkodu]
- Buvo—Blāna (Bouveault–Blanc) reducēšanā spirtus iegūst no esteriem, izmantojot metālisko nātriju etanola šķīdumā (etanols ir protonu avots). Reakcijai ir rūpnieciska nozīme.[8]

- Laboratorijā parasti izmanto jonu hidrogenēšanu. Esterus spēj hidrogenēt LiAlH4, bet nespēj NaBH4, kas ir pārāk mīksta bāze pēc Pīrsona. Karbonskābes LiAlH4 arī var reducēt, taču, ja gadījumā savienojums satur gan karboksilgrupu, gan estera grupējumu, LiAlH4 hidrēs esteri. Pretēji tam, diborāns "dod priekšroku" karbonskābes hidrogenēšanai.[12]

- Liša (Luche) reducēšanā par spirtiem tiek pārvērstas tikai karbonilgrupas, neskarot divkāršās saites (pat konjugētas), kā arī aldehīdgrupas reaģē lēnāk nekā ketogrupas. Netiek skartas no karboksilāta atvasinātās grupas, sulfīdi u. c. Šeit NaBH4 un arī karbonilgrupu aktivizē CeCl3, ko ievada reakcijas vidē – spirta šķīdumā (arī tas tiek CeCl3 aktivēts).[12]

- Mērveina—Pondorfa—Verleja (Meerwein–Ponndorf–Verley) reducēšana ir aldehīdu vai ketonu reducēšana ar izopropanolu alumīnija izopropanolāta pārākumā. Reakcija notiek caur periciklisku hidrīdjona pārnesi no izopropanolāta, kas piesaistīts alumīnija atomam, uz ketonu, kas veido ar to donorakceptorsaiti.[8][12]

- Tiščenko (Тищенко) reakcija – aldehīdu disproporcionēšanās alumīnija alkoksīdu klātbūtnē – arī notiek caur hidrīdjona pārnesi. Var izmantot arī citus alkoksīdus, taču tikai aldehīdiem, kas nespēj enolizēties (citādi notiks aldolā kondensācija).[8]

- Piemērā rodas esteris, kuru var hidrolizēt par spirtu un skābi.
- Kanicāro (Cannizzaro) reakcija notiek ar arēnkarbaldehīdiem sārmu vai sārmzemju metālu hidroksīdu klātbūtnē un ir analoģiska Tiščenko reakcijai.[8][12]

- Pinakonu iegūšana no karbonilsavienojumiem reakcijā ar metālisku nātriju, magniju, cinku vai citu aktīvu metālu. Reakcijas gaitā rodas ketilradikālis, kas dimerizējas.[8][12]

- Pazīstama arī citāda pinakona iegūšanas metode – hidrogenējot acetonu alumīnija klātbūtnē.[13]
Dažādas oksidēšanas reakcijas[labot šo sadaļu | labot pirmkodu]
- Fermentatīvās reakcijas
- Plaši pazīstamais variants, kas notiek spirta rūgšanas procesā, ir etanola rašanās no glikozes.
- Spirta rūgšana ir viens no senākajiem bioķīmiskajiem procesiem, ko pazīst cilvēce. Shēma augstāk ir vienkāršota, jo procesā ir daudzas stadijas, katru no kurām katalizē noteikts ferments (jeb enzīms), ko satur rauga sēnītes. Kā dažus no starpproduktiem reakcijā var minēt acetaldehīdu un glicerīnam tuvas vielas. Svarīgs starpprodukts ir piruvāts CH3C(O)COO-. Raudzēšanas produktu sastāvs ir atkarīgs gan no lietotās sēnītes šķirnes, gan no procesa apstākļiem; optimālos apstākļos var iegūt pat 95 % iznākumu (relatīvi pret teorētisko). Parastie blakusprodukti ir n-propilspirts, n-butilspirts, 3-metil-1-butanols (izoamilspirts) un 2-metil-1-butanols. Kopā tie veido 99 % (izoamilspirts un tā izomērs – ap 68 %) no tā saucamās sīveļļas, kas nosaka neattīrītā etanola ievērojamu toksiskumu. Bez minētām vielām sīveļļa satur arī dažus garākas ķēdes (C6—C9) spirtus, garākas ķēdes karbonskābes un slāpekļa savienojumus;[15], var saturēt arī izobutilspirtu un n-amilspirtu.[8] Sīveļļai piemīt nepatīkama smarža.[8][15]
- Modificējot procesu, raudzēšanas rezultātā var iegūt arī citas vielas, piemēram, to pašu glicerīnu, kas rodas no minētajiem starpproduktiem. Metilbutanolu maisījumu izmanto par izejvielu amilacetāta ražošanā, kas tiek izmantots pārtikas rūpniecībā kā bumbieru smaržviela. Amilspirtu esterus izmanto arī kā šķīdinātājus.[15]
- KMnO4 stipri bāziskā vidē var oksidēt kumola homologus par trešējiem arilalkanoliem.[12]
- Metālorganisko un bororganisko savienojumu oksidēšana
- Bororganisko savienojumu izmantošana ļauj no terminālajiem alkēniem iegūt pirmējos spirtus, kamēr tiešā hidratācijā būtu veidojušies otrējie. Diborāns (no kura ēterī veidojas monomēra ēterāts) pievienojas dubultsaitei pretēji Markovņikova likumībai, jo saitei B–H ir netipiska polaritāte (līdzīgi kā metālorganiskajos savienojumos). Iegūtos alkilborānus (parasti alkēna pārākumā izveidojas trialkilborāni) oksidējot (piemēram, ar H2O2), tiek iegūti borskābes esteri, kuru hidrolīze dod pirmējos spirtus.[8][12]
- Diborānu iegūst no joniskajiem hidrīdiem (piemēram, NaBH4) un bora trifluorīda ēterī.[11]
- Analoģiski arī alumīnijorganiskos savienojumus var oksidēt – šoreiz praksē (rūpniecībā) tiek izmantots skābeklis. Hidrolīzē iegūst spirtus un alumīnija hidroksīdu.[8]
- 1,2-Diolu iegūšana no alkēniem
- Vāgnera reakcijā KMnO4 pievienojas dubultsaitei un veido cis glikolus, taču ļoti jāuzmana koncentrācija un temperatūra, citādi var tikt šķelta C–C saite.[8]
- Pilnīgi analoģiski reaģē OsO4, kuru katalītiskos daudzumos izmanto Šārplesa (Sharpless) asimetriskās hidroksilēšanas metodē (arī iegūst cis glikolus). OsO4 reģenerē ar NaClO4, dzelzs cianoferātiem u. tml.[12]
- Prevo (Prevost) reakcijā uz alkēniem iedarbojas ar jodu un sudraba acilātiem bezūdens benzolā. Iegūti tiek trans 1,2-dioli.[12]
- Ūdens klātbūtnē veidojas cis 1,2-dioli (Vudvorda—Bruthera (Woodward–Brutcher) modifikācija).[12]
Spirtu ķīmiskās īpašības[labot šo sadaļu | labot pirmkodu]
Reakcijas ar skābekļa atoma saglabāšanu savienojumā[labot šo sadaļu | labot pirmkodu]
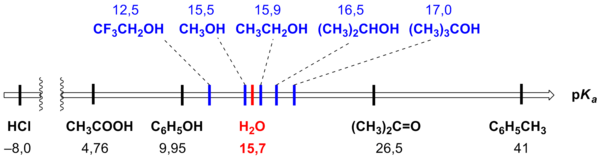
- Spirtiem piemīt skābes īpašības, jo saite O–H ir izteikti polāra (saites dipolmoments ir ap 1,5 debaji).[1] Tomēr alkanoli pārsvarā ir vājākas skābes par ūdeni, kas neizbrīna, jo alkilgrupām piemīt elektrondonors efekts, kura nav ūdens molekulā. Tāpēc trešējiem spirtiem ir visvājākās skābes īpašības, otrējiem tās ir stiprākas un pirmējiem – visstiprākās, taču vienalga vājas. Tādēļ ūdens šķīdumos alkanola anjons praktiski neuzrādās, atskaitot stipri sārmainus šķīdumus (pH > 14, kas ir vairāk par pKH₂O). Metanols ir izņēmums, jo tā protolīzes konstante ir nedaudz zemāka nekā ūdenim (attiecīgi 15,2 un 15,7).[1] Tāpat arī spirti ar elektronakceptoriem aizvietotājiem virknē var izrādīties visai skābi. Zemāk dotas pKa vērtības dažiem spirtiem salīdzinājumā ar citām vielām.
- Alkanolu disociācijas produkts ir alkanolātanjons, savā uzbūvē analogs hidroksīdanjonam.[8]

- Analoģiski kā no ūdens, arī no spirtiem aktīvie metāli izdala atomāru ūdeņradi (in statu nascendi), kas pēc tam dimerizējas. Otrs reakcijas produkts ir metāla alkoholāts jeb alkoksīds.
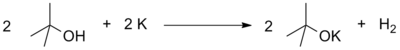
- Tā kā spirti ir vājas skābes, tad alkoholāti, saskaņā ar Brensteda—Louri protolīzes teoriju, ir stipras bāzes, stiprākas par hidroksīdiem.Tādēļ tos plaši pievieno sintēzē karbanjonu ģenerēšanai, piemēram, Klaizena kondensācijā.[8][jāprecizē]

- Tāpat tos lieto dubulto un trīskāršo saišu iegūšanai no halogēnogļūdeņražiem. Piemērā zemāk aizvietošanas:

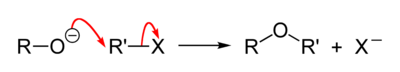
- Alkoholātjoni ir arī stipri nukleofili. Tie viegli acilējas, veidojot karbonskābju esterus. Tāpat tie viegli alkilējas ar alkilhalogenīdiem – Viljamsona (Williamson) ēteru sintēze. Iepriekšējā reakcijā šādai reakcijai neļauj notikt apjomīgās metilgrupas pie potenciālā reakcijas centra. Vispārīgā gadījumā Viljamsona reakcija noris šādi.[8]
- Spirti ir arī vājas bāzes, jo skābeklim ir nesapārotie elektronu pāri. Līdzīgi ūdenim, spirti tātad ir amfiproti protolīti.

- Iegūto anjonu dēvē par alkoksonija katjonu – hidroksonija katjona H3O+ alkilatvasinājumu. Vispārīgā gadījumā spirts var pievienot jebkuru elektrofilu daļiņu, ne tikai ūdeņraža jonu; tad veidojas citi oksonija joni, kuru kopējā iezīme ir trīsvērtīgs skābekļa atoms. Piemēram, oksonija jons veidojas esterifikācijas reakcijā.[8]

- Nereti reakciju realizē, karsējot spirtu kopā ar karbonskābi un skābu katalizatoru. Tad to sauc par Fišera—Špeijera (Fischer—Speier) esterificēšanu.[nepieciešama atsauce] Līdzīgi var iegūt arī neorganisku skābekli saturošu skābju esterus – nitrītus, nitrātus. Piemēram, šādi iegūst labi pazīstamu sprāgstvielu un bioloģiski aktīvu vielu nitroglicerīnu (faktiski gliceriltrinitrātu).

- Acilēt var arī ar halogēnanhidrīdiem vai anhidrīdiem. Tā iegūst arī fosforskābes esterus.[8] Reakcijas ir neapgriezeniskas (atšķirībā no Fišera—Špeijera gadījuma), kas ir priekšrocība, bet vienlaicīgi rodas ļoti korozīvi halogēnogļūdeņraži.
- Spirtu pievienošanās dubultām un trīskāršajām saitēm
- Spirti, līdzīgi ūdenim, spēj pievienoties dubultām un trīskāršajām saitēm. Pievienojoties dubultsaitei, rodas alkilēteri.

- Šo reakciju lieto ēteru iegūšanai, kad citas metodes neder; piemēram, trešējo alkilhalogenīdu un citu sazarotas virknes alkilhalogenīdu gadījumā Viljamsona reakcija ir nepiemērota, jo iegūtais karbkatjons viegli eliminē protonu, veidojot blakusproduktus alkēnus. Toties sazarotie alkēni (piemēram, izobutilēns, izoamilēns) ir ļoti reaģētspējīgi attiecībā uz spirtu pievienošanu, jo šiem olefīniem ir izteiktākas bāziskās īpašības. No spirtiem šajā reakcijā visaktīvākie ir pirmējie spirti. Piemēram, šādi rūpniecībā iegūst diizopropilēteri no propēna un izopropilspirta BF3 klātbūtnē.[11]
- Pievienojoties alkīniem (labāk Hg2+ vai Cu+ klātbūtnē),[nepieciešama atsauce] spirti veido vinilēterus, kas ir stabili enolu atvasinājumi.
- Spirtu oksidēšana
- Labs oksidētājs otrējiem spirtiem (par ketoniem) ir Džonsa (Jones) reaģents (CrO3 vai K2Cr2O7 un H2SO4, abi nelielā koncentrācijā, acetona šķīdumā). Tas neoksidē molekulā esošās dubultsaites, pat alilstāvoklī. Pirmējos spirtus tas gan oksidē par karbonskābēm.[12]

- Metālu oksoskābju joni parasti oksidē spirtus caur šo skābju esteru veidošanu, kuri pēc tam sadalās, metālam mainot savu oksidēšanas pakāpi.[12]

- Lai no pirmējiem spirtiem iegūtu aldehīdus, nepieciešami citi, mazāk aktīvi reaģenti. Agrāk tika plaši lietots piridīnija hlorhromāts un piridīnija dihromāts (PCC un PDC), taču šīs vielas ir visai toksiskas. Mūsdienās vairāk lieto oksidēšanu ar dimetilsulfoksīdu (DMSO), piemēram, Sverna (Swern) oksidēšanu un Mofata–Pficnera (Moffatt—Pfitzner) oksidēšanu. Aktīva daļiņa pirmajā gadījumā ir dimetilhlorsulfonija jons (analogs oksonija jonam), kurš rodas šādi.[12]

- Tālāk hlors apmainās ar spirta skābekli, un notiek sigmatropā pārgrupēšanās.[12]
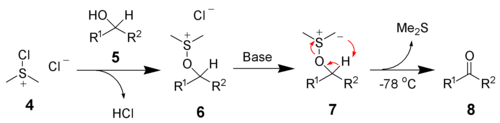
- Mofata—Pficnera gadījumā DMSO tiek aktivēts, pievienojoties pie protonēta dicikloheksilkarbodiimīda (vai cita karbodiimīda).[12]

- Abos gadījumos trūkums ir gaistošā, smacīgā un ļoti indīgā dimetilsulfīda rašanās reakcijā. Sverna reakcijas pluss ir iespēja oksidēt savienojumus, jo reakcijas vidē nav skābes. Mofata—Pficnera reakcijā lieto katalītisku daudzumu skābes,[12] kā arī ir grūti atdalīt blakusproduktu – aizvietoto urīnvielu. Savukārt Sverna reakcija ir jārealizē pazeminātā temperatūrā (–60…–50 °C).[12]
- Laba alternatīva ir oksidēšana ar Dessa—Martina (Dess—Martin) perjodinānu (DMP) jeb 1,1,1-tris(acetoksi)-1λ5,2-benz[c]jodoksol-3(1H)-onu. Dessa—Martina perjodināns ir ļoti maigs oksidējošais aģents: netiek skarts furāna gredzens, vinilēteri, otrējie amīdi, sulfīdi. Netiek oksidēti arī aizsargātie amīni. DMP spēj oksidēt alilspirtus par α,β nepiesātinātajiem karbonilsavienojumiem. Reakcijas ar DMP notiek istabas temperatūrā un pie neitrāla pH. Acetilgrupas pie joda atoma nodrošina šī reaģenta labu šķīdību daudzos organiskos šķīdinātājos.[12]

- Reakcijā piecvērtīgais jods tiek reducēts par trīsvērtīgo.
- Bez tam, alilspirtu un benzilspirtu oksidēšanai izmanto vara acetātu, o-hloranilu jeb o-TCQ, kā arī sudraba karbonātu vai MnO2 aprotiskos šķīdinātājos.[12]
- Selektīvi otrējos spirtus oksidē Openauera (Oppenauer) oksidētājs – acetons alumīnija triizopropanolāta klātbūtnē. Reakcija ir apgriezenisks process Mērveina—Pondorfa—Verleja reakcijai; līdzsvaru nobīda, veicot sintēzi acetona un benzola maisījumā. Aldehīdi pēc Mērveina, Pondorfa un Verleja reducējas ievērojami aktīvāk nekā ketoni,[12] kādēļ ir grūtāk panākt to oksidēšanos apgriezeniskajā reakcijā.[nepieciešama atsauce]

Reakcijas, kurās skābekļa atoms aiziet no spirta molekulas[labot šo sadaļu | labot pirmkodu]
Nereti oksonija jona veidošanās izraisa karbkatjona atšķelšanu vai nukleofilās aizvietošanās reakcijas pie spirta α atoma.[8]
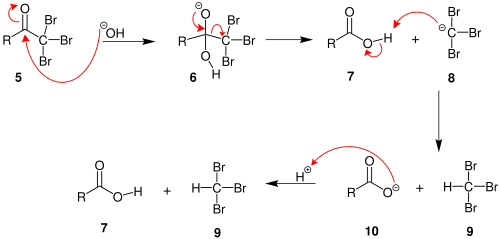
- Viens piemērs ir apgriezenisks process vienai no spirtu sintēzes metodēm – hidroksilgrupas aizvietošana ar halogēna atomu reakcijā ar halogēnūdeņražiem. Ūdens šķīdumā reakcijā stājas HCl, HBr un HI, HF ir pārāk asociēta un vāja skābe. Uz to balstās viena sena metode dažādu spirtu izšķiršanai. Lūkasa (Lucas) reaģents ir bezūdens ZnCl2 (Lūisa skābes) šķīdums koncentrētā sālsskābē; reakcija notiek caur hidroksilgrupas migrāciju uz cinka atomu un karbkatjona ģenerēšanu. Trešējie spirti reaģē ļoti ātri, otrējie dažu minūšu laikā, bet pirmējie istabas temperatūrā nereaģē vispār. Reakcijas norisi iezīmē šķīduma saduļķošanās, jo hlorogļūdeņradis parasti nešķīst tik polārā vidē. Tomēr sildot var iegūt arī labus iznākumus hloralkāniem.[nepieciešama atsauce]

- Halogēnūdeņražus bieži ģenerē reakcijas maisījumā no sārmu metālu halogenīdiem un sērskābes; jodūdeņražskābi ģenerē no sarkanā fosfora, joda un ūdens.[8]
- Reakcijās ar neorganisko skābju halogēnanhidrīdiem (PCl3, POCl3, SOCl2, SF4) veidojas halogēnalkāni, kā blakusprodukti – šo skābju esteri. Reakcijā notiek nukleofilā aizvietošana, parasti iekšmolekulāra (SNi),[8] bet bāzes klātbūtnē – starpmolekulārā (SN2). Ja bāzes nebūtu, piridīnija gredzena vietā pēdējās stadijas izejas daļiņā paliktu Cl atoms, kurš arī aizvietotu O atomu pie alkilgrupas, vienlaicīgi atšķeļoties no sēra.

- Neorganisko skābekli saturošo skābju esteri veidojas no alkanoliem, tiem mijiedarbojoties ar šīm skābēm; ja savienojums nav izteikti skābs, reakcijas maisījumu paskābina ar sērskābi. Piemēram, tā sintezē borskābes esterus.[8]

- Stipru skābju klātbūtnē alkanoli spēj darboties kā alkilējošie reaģenti, jo tiek ģenerēti karbkatjoni. Piemērs ir pašalkilēšana ne pārāk koncentrētā un ne pārāk siltā skābē – ēteru rašanās.[8]

- Alkilējot ar spirtiem, skābju katalītiskā aktivitāte samazinās rindā HF > H2SO4 > P2O5 > H3PO4. Fosfora pentoksīds ir labāks katalizators par fosforskābi, jo darbojas arī kā ūdensatņēmēja viela. Kā katalizatorus izmanto arī p-tolilsulfoskābi (tozilskābi), kā arī Lūisa skābes.[16]
- Lūisa skābju klātbūtnē tiek alkilēti, piemēram, arēni. Bora trifluorīds kā elektrofils reaģents pievienojas spirta skābekļa atomam un atšķeļ hidroksilgrupu, atbrīvojot karbkatjonu un pašam pārvēršoties par anjonu [HOBF3]—. Tālāk karbkatjons alkilē aromatisko ogļūdeņradi.
- Tā kā starpprodukts ir karbkatjons, tas tiecas pārgrupēties reakcijas vidē. Tādēļ, alkilējot benzolu ar n-butilspirtu BF3 un P2O5 klātbūtnē, rodas izobutilbenzols.[16]
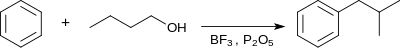
- Bez BF3 izmanto arī AlCl3, SnCl4, ZnCl2. AlCl3, piemēram, palīdz novērst karbkatjona izomerizēšanos, jo alkilēšanā ar n-propilspirtu benzola pārākumā iegūst n-propilbenzolu un meta-di-n-propilbenzolu. No otras puses, metālu gadījumos problēmas rada blakusreakcija: komplekss ar katalizatoru izšķeļ halogēnūdeņradi un, piemēram, no AlCl3 veidojas AlOCl (oksohlorīds), bet no spirta – halogēnatvasinājums.[16]
- Zemākie spirti ir slikti alkilēšanas reaģenti, bet alifātiskie spirti C4—C12 un benzilspirts un tā homologi ir labi alkilētāji, īpaši BF3 + P2O5 klātbūtnē.[16]
- Spirtu dehidratācija
- Stipru skābju vai katalizatora (piemēram, Al2O3) klātbūtnē paaugstinātā temperatūrā spirti atšķeļ ūdeni. Reakcija notiek caur karbkatjona (stabilākā no iespējamajiem) vai skābes estera veidošanos, kurš pēc tam atšķeļ protonu. Īpaši viegli atšķelšana notiek trešējo spirtu gadījumā.[8]

- Ķīmiskās rūpniecības vēsturē spirtu dehidratācijas reakcijai ir nozīmīga vieta, jo to izmantoja izejvielu iegūšanai vairāku dažādu sintētisko kaučuku šķirņu radīšanai. Īpaši aktuāls šis uzdevums bija valstīs ar ierobežotu piekļuvi dabīgā kaučuka ieguves vietām (kolonijas ar tropisku klimatu, kur audzēja hevejas kokus (Dienvidamerika) vai gutaperčas kokus (Dienvidaustrumāzija)). Tieši dehidratācijas reakcija ļāva pirmoreiz (1916. g., karojošā Vācijā) radīt sintētiskā kaučuka rūpniecisku ražošanas metodi. Ar jau minēto acetona hidrogenēšanas metodi Al klātbūtnē ieguva pinakonu un pēc attīrīšanas dehidratēja ar KHSO4.[13]

- Metilkaučukam piemita daudz neizdevīgu īpašību,[8] taču tas bija tikai pirmais solis. 1927. g. tirdzniecības ziņā izolētajā PSRS Sergejs Ļebedevs radīja veidu 1,3-butadiēna sintēzei no etilspirta, kas pavēra iespēju sākt butadiēnkaučuka ražošanu.

- Reakcija notiek spirta tvaikos virs uzkarsēta Al2O3+ZnO katalizatora.[13] Uzskata, ka virs katalizatora etanols dehidratējas par acetaldehīdu, tālāk seko aldolā kondensācija un iegūtā aldola pārvērtības.[17]
- Spirtu karbonilēšana
- Oglekļa monoksīdu uz kobalta katalizatora (piemēram, HCo(CO)4) var iestarpināt starp R un OH saiti spirtos. Uzskata, ka arī šeit veidojas karbkatjons.[8]

- Šis kobalta komplekss ir skābs, tādēļ vispirms notiek alkoksonija jona veidošanās. Reakcijai ir rūpnieciska nozīme.
- Karbkatjonu pārgrupēšanās
- Alilpārgrupēšanās notiek ar alilkatjonu, kas rodas, atšķeļoties ūdenim no protonētā alilspirta. Katjonam ir divi reakciju centri, un jebkurās tālākās reakcijās iegūs produktu maisījumu. Izomēru attiecības būs atkarīgas no abu alilkatjona mezomēro struktūru relatīvās stabilitātes un tātad no to īpatsvara reālajā alilkatjona struktūrā.[8]

- Nukleofils reaģents vairāk uzbruks izteiktākam elektrofilajam centram katjonā.
- Retropinakolīna pārgrupēšanās – spirta dehidratācija skābes klātbūtnē, ja α C atomam nav klāt H.[18] Šajā gadījumā veidotajā karbkatjonā notiek alkilgrupas migrācija pie blakusesošā oglekļa atoma. Līdzīgi mēdz notikt pārgrupēšanās bicikloalkānos, piemēram, borneola pārgrupēšanās par kamfēnu. To sauc par Vāgnera—Mērveina pārgrupēšanos,[8] taču dažkārt šādi dēvē visas reakcijas ar alkilgrupas migrāciju karbkatjonā, tajā skaitā arī pinakolīnpārgrupēšanos.[19] Zemāk ir piemērs ar apgriezenisku procesu, kurā no α-pinēna tiek iegūts kampars.


- Haloformu reakcija
- Haloformu reakcija ir īpatnējs daudzpakāpju process, kurā no etanola vai otrējiem spirtiem, kas satur metilgrupu pie C—OH saites (arī no acetaldehīda un metilketoniem) veidojas haloformi (hloroforms, bromoforms vai jodoforms). Reakcija notiek, pievienojot joda spirta šķīdumam sārma šķīdumu.[20]
- Pirmajā stadijā rodas spēcīgs oksidētājs – hipohalogenītanjons (IO-, BrO- vai ClO-), kas oksidē spirtu līdz karbonilsavienojumam:

- Otrajā stadijā halogenējas karbonilsavienojuma enolātanjons:
- Trešajā stadijā trishalogēnmetilgrupu nukleofīli aizvieto hidroksīdjons; pēc tam trihalogēnmetīdanjons atrauj iegūtajai skābei protonu, un rodas haloforms.
- Šo reakciju kādreiz lietoja etanola, otrējo spirtu ar metilgrupu pie C—OH un metilketonu noteikšanai (mūsdienās pārsvarā izmanto spektroskopiskās metodes, kā KMR un IS spektroskopiju). Haloforma reakcija ir pazīstama ļoti sen, vismaz kopš 1822;[21] Pārbaudi ar jodoformu ieteica Ādolfs Lībens 1871. gadā.[22]
Fenoli un enoli[labot šo sadaļu | labot pirmkodu]
Ja hidroksilgrupa atrodas pie sp2 hibridizēta oglekļa atoma, tad attiecīgos savienojumus nepieskaita pie spirtiem. Ja hidroksilgrupa atrodas tieši pie benzola gredzena vai cita aromātiskā cikla, tad šo savienojumu sauc par fenolu. Ja −OH grupa atrodas pie nepiesātināta ogļūdeņraža dubultsaites, tad savienojumu sauc par enolu. Enoli ir visai nestabili un pēc rašanās izomerizējas (tautomerizējas) par aldehīdiem (Eļtekova—Erlenmeiera likumība), parasti tas notiek dažu sekunžu līdz dažu desmitu minūšu laikā. Tomēr vienalga enols kā tautomērā forma pastāv šķīdumā. Dažu vielu enolformas var būt visai stabilas, piemēram, pentafluor-1-propēn-2-ols.[23]
Pazīstamākie spirti un to triviālie nosaukumi[labot šo sadaļu | labot pirmkodu]
- Vienvērtīgie spirti:
- Pirmējie spirti
- Etanols — CH3CH2OH
- Metanols — CH3OH
- Tribrometanols, avertīns jeb narkolāns (CBr3CH2OH) — spēcīgs narkotiskais līdzeklis, kādreiz izmantots anestēzijā, tagad pielietots veterinārijā kā līdzeklis pret parazītiem[24]
- Amilspirts — n-C5H11OH
- Izoamilspirts — i-C5H11OH (3-metil-1-butanols)
- Neopentilspirts — 2,2-dimetil-1-propanols
- Cetilspirts — n-heksadekanols, n-C16H33OH (ietilpst no kašalotiem iegūstamajā spermacetā, ko izmanto kosmētikā)
- Miricilspirts — n-trikozanols, n-C30H61OH (ietilpst vaska sastāvā)
- Otrējie spirti
- Izopropanols — (CH3)2CHOH
- Izobutanols — 2-butanols
- Pairkla spirts
- Pirmējie spirti
- Trešējie spirti
- Terc-butanols — (CH3)3COH
- Terc-amilspirts — 2-metil-2-butanols
- Teksilspirts jeb terc-heksilspirts (2,3-dimetil-2-butanols)
- Linalools
- Sobrerols
- Alkenoli
- Alilspirts
- Geraneols
- Linalools
- Retinols (A vitamīns)
- Alkinoli
- Cikloalkanoli un cikloalkenoli
- Arenoli
- Benzilspirts
- 2-fenil-1-etanols
- Trifenilmetanols
- Trešējie spirti

- Vairākvērtīgie spirti:
- Etilēnglikols (1,2-etāndiols)
- Propilēnglikols (1,2-propāndiols)
- Pinakons (2,3-dimetil-butān-2,3-diols)
- 1,4-butilēnglikols jeb 1,4-butāndiols (izejviela tetrahidrofurānam)
- Glicerīns (1,2,3-propāntriols)
- Eritrīts (1,2,3,4-butāntetraols)
- Pentaeritrīts
- Pentīti (1,2,3,4,5-pentānpentaoli) un heksīti (1,2,3,4,5,6-heksānheksaoli) — cukura aizvietotāji; daudz stereoizomēru
- Inozitols — 1,2,3,4,5,6-cikloheksānheksaols (arī daudz stereoizomēru)
Holesterīns arī ir spirts (cikloalkenols), bet tam ir visai sarežģīta molekulas uzbūve.
Atsauces[labot šo sadaļu | labot pirmkodu]
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 Нейланд 1990, 281.—288. lpp
- ↑ Химическая энциклопедия, 1992, т. 3, с. 118—119 (krieviski)
- ↑ 3,00 3,01 3,02 3,03 3,04 3,05 3,06 3,07 3,08 3,09 Пальм, В. А. Введение в теоретическую органическую химию. Высшая школа: Москва, 1974.— с. 176–216.
- ↑ Бабушкин, А. А. Бажулин, П. А. Королёв, Ф. А. и др. Методы спектрального анализа. Изд-во Московского Университета: Москва, 1961. — с. 250–251; 262–263.
- ↑ Valters, R. Kodolu magnētiskās rezonanses spektroskopija. RTU Izdevniecība: Rīga, 2008. – 130. lpp. (pārpublicēts no: Pretsch, E. Bühlmann, P. Affolder, C. Structure determination of organic compounds. Tables of spectral data, 3rd ed. Springer: Berlin, 2000, 421 p.)
- ↑ Chem605 NMR Spectroscopy. Sadaļas 5.02 un 6.2. Tīmeklī: http://www.chem.wisc.edu/areas/reich/chem605/index.htm
- ↑ 7,0 7,1 7,2 7,3 NIST Chemistry WebBook: Phase change data. http://webbook.nist.gov/chemistry/
- ↑ 8,00 8,01 8,02 8,03 8,04 8,05 8,06 8,07 8,08 8,09 8,10 8,11 8,12 8,13 8,14 8,15 8,16 8,17 8,18 8,19 8,20 8,21 8,22 8,23 8,24 8,25 8,26 8,27 8,28 8,29 Нейланд 1990
- ↑ Gudriniece 1976, 150.—152. lpp
- ↑ Степаненко 1951, 107. lpp
- ↑ 11,0 11,1 11,2 11,3 11,4 Gudriniece 1976, 106.—118. lpp
- ↑ 12,00 12,01 12,02 12,03 12,04 12,05 12,06 12,07 12,08 12,09 12,10 12,11 12,12 12,13 12,14 12,15 12,16 12,17 12,18 12,19 12,20 12,21 12,22 12,23 Plotniece, M. Lekciju materiāli RTU MLĶF ĶK priekšmetā ĶVĶ527 "Sintētiskā organiskā ķīmija". Rīga, 2014.
- ↑ 13,0 13,1 13,2 Степаненко 1951, 81. lpp
- ↑ «Спиртовое брожение». Biologymic.ru. Arhivēts no oriģināla, laiks: 2015. gada 31. janvārī. Skatīts: 2014. gada 3. septembrī. (krieviski)
- ↑ 15,0 15,1 15,2 Степаненко 1951, 115.—120. lpp
- ↑ 16,0 16,1 16,2 16,3 Gudriniece 1976, 61.—63. lpp
- ↑ Нейланд 1990, 132. lpp
- ↑ Нейланд 1990, 294. lpp
- ↑ Меди — Полимерные // Химическая энциклопедия в 5 томах. — М.: Большая Российская Энциклопедия, 1992. — Т. 3. — 639 с.
- ↑ Степаненко 1951, 93.—94. lpp
- ↑ László Kürti and Barbara Czakó (2005). Strategic Applications of Named Reactions in Organic Synthesis. Amsterdam: Elsevier. ISBN 0-12-429785-4.
- ↑ Reynold C. Fuson and Benton A. Bull (1934). "The Haloform Reaction". Chemical Reviews 15 (3): 275–309. doi:10.1021/cr60052a001.
- ↑ Нейланд 1990, 310. lpp
- ↑ «АВЕРТИН (Avertinum) / Справочник ветеринарных препаратов / Московский Ветеринарный WEB-Центр». Arhivēts no oriģināla, laiks: 2013. gada 13. martā. Skatīts: 2014. gada 23. jūnijā.
- ↑ William H. Pirkle, David L. Sikkenga, Mark S. Pavlin (1977). "Nuclear magnetic resonance determination of enantiomeric composition and absolute configuration of γ-lactones using chiral 2,2,2-trifluoro-1-(9-anthryl)ethanol". J. Org. Chem. 42 (2): 384–387. doi:10.1021/jo00422a061.
Literatūra[labot šo sadaļu | labot pirmkodu]
- Нейланд, О. Я. Органическая химия. Высшая школа: Москва, 1990
- Степаненко, Б. М. Органическая химия. Медгиз:Москва, 1951
- Gudriniece, E. Kārkliņa, A. Strakova, I. Organisko savienojumu sintēzes metodes. Zvaigzne: Rīga, 1976
Galvenie avoti[labot šo sadaļu | labot pirmkodu]
| Vikikrātuvē par šo tēmu ir pieejami multivides faili. Skatīt: spirti |
- Plotniece, M. Lekciju materiāli RTU MLĶF ĶK priekšmetā ĶVĶ527 "Sintētiskā organiskā ķīmija". Rīga, 2014.
- Нейланд, О. Я. Органическая химия. Высшая школа: Москва, 1990. – 751 с.
| ||||||||
|











![{\displaystyle {\mbox{Ar}}-{\mbox{H}}+{\mbox{R}}^{{}+{}}[{\mbox{HO}}-{\mbox{BF}}_{3}]^{{}-{}}~\rightarrow ~{\mbox{Ar}}-{\mbox{R}}+{\mbox{H}}^{{}+{}}[{\mbox{HO}}-{\mbox{BF}}_{3}]^{{}-{}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2dd0f3261981436d0980c3c18e77b76c0652da86)