Dislāpekļa oksīds
| Dislāpekļa oksīds | |
|---|---|
 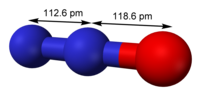 Dislāpekļa oksīda molekulas modeļi  Dislāpekļa oksīda struktūrformula | |
| Citi nosaukumi |
slāpekļa(I) oksīds, slāpekļa oksiduls, smieklu gāze, jautrības gāze, slāpekļa(V) oksonitrīds |
| CAS numurs | 10024-97-2 |
| Ķīmiskā formula | N2O |
| Molmasa | 44,013 g/mol |
| Blīvums | 1,977 kg/m3 |
| Kušanas temperatūra | −90,86 °C |
| Viršanas temperatūra | −88,48 °C |
| Šķīdība ūdenī | 0,15 g/100 ml (15 °C) |
Dislāpekļa oksīds (N2O) ir slāpekļa un skābekļa binārais savienojums — viens no slāpekļa oksīdiem. Normālos apstākļos dislāpekļa oksīds ir bezkrāsaina, nedegoša (degšanu uzturoša), par gaisu smagāka gāze ar vāju, patīkamu saldenu smaržu un piegaršu. Nav indīgs, bet ieelpojot rada reibinošu efektu, tādēļ tiek saukts par smieklu gāzi vai jautrības gāzi. Šķīst ūdenī, bet nereaģē ar to (ir viens no retajiem sāļus neradošajiem oksīdiem). Šķīst arī etilspirtā, ēterī, sērskābē. 40 atmosfēru spiedienā istabas temperatūrā dislāpekļa oksīds kļūst šķidrs. Maisījumā ar ūdeņradi, amonjaku, ētera tvaikiem, ciklopropānu un citām degošām vielām var būt sprādzienbīstams.
Vēsture
[labot šo sadaļu | labot pirmkodu]Pirmo reizi ieguvis angļu ķīmiķis Džozefs Prīstlijs 1772. gadā.[1] 18. gadsimta beigās ar slāpekļa oksidulu eksperimentēja Hamfrijs Deivijs un 1800. gadā publicēja atklājumu, ka šī viela reibina un novērš sāpes.[2] Sākumā "jautrības gāze" tika izmantota izklaides nolūkos dažādos saietos un gadatirgos, bet tikai 1844. gadā zobārsts Horācijs Velss, eksperimentējot ar sevi, mēģināja to izmantot sāpju novēršanai zoba raušanas laikā. Pirmie eksperimenti nebija īpaši veiksmīgi, turklāt tika atklāts labāks narkozes līdzeklis — ēteris. Pēc Pirmā pasaules kara interese par jautrības gāzes anestētiskajām īpašībām pieauga un to lietoja ne tikai zobārsti, bet dažreiz arī ķirurgi. Kad tika atklāts hloroforms un vēl spēcīgāki narkozes līdzekļi, smieklu gāzes loma anestezioloģijā mazinājās.
Iegūšana
[labot šo sadaļu | labot pirmkodu]Visvienkāršāk dislāpekļa oksīdu var iegūt, uzmanīgi karsējot sausu amonija nitrātu. Reakcija sākas pie 170 °C un ir eksotermiska (norisinās ar siltuma izdalīšanos), tādēļ karsēšana laikus jāpārtrauc, nepārsniedzot 250 °C, lai nenotiktu sprādziens.
- NH4NO3 → N2O↑ + 2H2O.
Nedrīkst šādā ceļā iegūtu N2O mēģināt ieelpot, jo tas var saturēt indīgus piemaisījumus (citus slāpekļa oksīdus un slāpekļskābes tvaikus).
Ērtāks paņēmiens ir sulfamīnskābes reakcija (sildot) ar 73% slāpekļskābi:
- NH2SO2OH + HNO3 → N2O↑ + H2SO4 + H2O.
Molekulas uzbūve
[labot šo sadaļu | labot pirmkodu]Dislāpekļa oksīdu bieži dēvē par slāpekļa(I) oksīdu ar struktūrformulu N−O−N. Tas ir nepareizi, jo slāpeklis nemēdz būt vienvērtīgs. Dislāpekļa oksīda molekulā abiem slāpekļa atomiem ir dažādas oksidēšanas pakāpes. Tās vidū atrodas slāpekļa, nevis skābekļa atoms. Šim slāpekļa atomam oksidēšanas pakāpe ir +5, bet otram, malējam, slāpekļa atomam −3. Skābeklim, kā parasti, oksidēšanas pakāpe ir −2. Tādējādi dislāpekļa oksīdu var uzskatīt par slāpekļa(V) oksonitrīdu. Centrālā slāpekļa atoma valences orbitāles ir sp hibridizācijas stāvoklī, tādēļ dislāpekļa oksīda molekula ir lineāra. Līdzīga uzbūve ir azīda negatīvajam jonam N3−, tikai tajā centrālajam slāpeklim pievienoti divi slāpekļa atomi ar oksidēšanas pakāpēm −3.
Ķīmiskās īpašības
[labot šo sadaļu | labot pirmkodu]
Dislāpekļa oksīds normālos apstākļos ir samērā inerts, bet sildot iedarbojas kā oksidētājs:
- N2O + H2 → N2 + H2O;
- N2O + C → N2 + CO.
Reaģējot ar stipriem oksidētājiem, N2O var pildīt reducētāja lomu:
- 5N2О + 8KMnO4 + 7H2SO4 → 5Mn(NO3)2 + 3MnSO4 + 4K2SO4 + 7H2O.
Karsējot sadalās, izdalot skābekli:
- 2N2O → 2N2 + O2.
Tādēļ organiskas vielas var degt tīrā dislāpekļa oksīdā.
Bioloģiskā iedarbība
[labot šo sadaļu | labot pirmkodu]Ieelpojot dislāpekļa oksīdu nelielās koncentrācijās, rodas reibuma sajūta un viegla miegainība. Elpojot šo gāzi lielās koncentrācijās vai tīrā veidā, rodas spēcīgs disociatīvs stāvoklis ar eiforiju, pilnīgu maņu un realitātes zudumu, ko var pavadīt vieglas, sapņiem līdzīgas halucinācijas. Iedarbība sāk mazināties un izbeidzas, tiklīdz tiek pārtraukta gāzes elpošana.
Gāzi tīrā veidā nedrīkst elpot ilgāk par 1—2 minūtēm, jo sāk iestāties asfiksija (nosmakšana) skābekļa trūkuma dēļ. Ilgstoši un bieži lietojot gāzi, tā rada B12 vitamīna zudumu organismā, kas izraisa nejutību locekļos.[3]
Izmantošana
[labot šo sadaļu | labot pirmkodu]Tā kā dislāpekļa oksīds nav toksisks un pēc tā ieelpošanas praktiski nav paliekošu blakusparādību, maisījumā ar skābekli to lieto medicīnā inhalācijas narkozei. Tomēr dislāpekļa oksīda narkotiskā iedarbība ir vāja, tādēļ nepieciešamas lielas koncentrācijas. Parasti to izmanto kopā ar citiem, spēcīgākiem narkozes preparātiem, kā arī miorelaksantiem.
Tā kā dislāpekļa oksīds viegli izdala skābekli, to lieto iekšdedzes dzinēju jaudas palielināšanai, iesmidzinot ieplūdes kolektorā.
Pārtikas rūpniecībā lieto kā propelentu un iesaiņojuma gāzi (E942).
Literatūra
[labot šo sadaļu | labot pirmkodu]- Nails Ahmetovs. Neorganiskā ķīmija. Rīga, Zvaigzne, 1978, 376. lpp.
Atsauces
[labot šo sadaļu | labot pirmkodu]| Vikikrātuvē par šo tēmu ir pieejami multivides faili. Skatīt: dislāpekļa oksīds |
- ↑ Keys TE (1941). "The_Development_of_Anesthesia". Anesthesiology journal 2: 552–574. lpp.
- ↑ Hugo Glāzers. Dramatiskā medicīna. Rīga, "Liesma", 1968, 74. lpp.
- ↑ https://www.erowid.org/chemicals/nitrous/nitrous_effects.shtml
| Slāpekļa oksīdi | |||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
|

