Sērs
- Šis raksts ir par ķīmisko elementu. Par citām jēdziena S nozīmēm skatīt nozīmju atdalīšanas lapu.
| Sērs | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
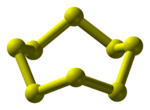  S8 molekulas uzbūve un sēra kristāli | |||||||
| Oksidēšanas pakāpes | 6, 4, 2, −2 | ||||||
| Elektronegativitāte | 2,58 | ||||||
| Blīvums | 2070 kg/m3 | ||||||
| Kušanas temperatūra | 388,36 K (115,21 °C) | ||||||
| Viršanas temperatūra | 717,87 K (444,6 °C) | ||||||
Sērs ir ķīmiskais elements ar simbolu S un atomskaitli 16. Sērs ir nemetāls, kurš pieskaitāms pie halkogēniem, lai arī bieži vien šo grupu īpaši neizdala. Sērs deg (bet diezgan slikti), ar zilu liesmu, veidojot sēra dioksīdu. Rūpnieciski nozīmīgākais sēra savienojums ir sērskābe.
Vēsture
[labot šo sadaļu | labot pirmkodu]Sērs pieder pie elementiem, kas pazīstami no aizvēsturiskiem laikiem. Iespējams, tā nosaukums cēlies no sanskrita vārda sira — gaišdzeltens.
Atrašanās dabā
[labot šo sadaļu | labot pirmkodu]
Sērs ir sastopams dabā tīrradņu veidā un savienojumos — sulfīdos (sulfīdu rūdās), sulfātos (lielos daudzumos jūras ūdenī), kā arī dažu paveidu naftā un akmeņoglēs. Sērs pēc izplatības Zemes garozā ir piecpadsmitajā vietā (0,05% pēc masas, 0,03% pēc atomu skaita).[1]
Svarīgākie dabā atrodamie sēra savienojumi:
- FeS2 — pirīts, dzelzs kolčedāns
- ZnS — cinkmānis
- PbS — svina spīde jeb galenīts
- HgS — cinobrs
- CaSO4·2H2O — ģipsis
- Na2SO4·10H2O — glaubersāls
- MgSO4·7H2O — rūgtais sāls
Dabas ūdeņos sērs sastopamības ziņā ir sestais elements. Sulfāta joni rada saldūdens pastāvīgo (nepārejošo) cietību.
Izotopi
[labot šo sadaļu | labot pirmkodu]Uz Zemes sērs sastopams četru stabilu izotopu veidā. Izplatītākais izotops ir 32S (95,084%), kā arī 34S (4,16%). Izotopi 33S un 36S sastopami niecīgā daudzumā. Mākslīgi iegūti β radioaktīvie 31S un 37S.
Bioloģiskā nozīme
[labot šo sadaļu | labot pirmkodu]Sērs pieder pie biogēnajiem elementiem, jo ietilpst dažu aminoskābju (cisteīna, metionīna) sastāvā, kā arī citās bioloģiski aktīvās vielās. Sērs ir svarīgs elements cilvēka organismam.
Iegūšana
[labot šo sadaļu | labot pirmkodu]Sēru galvenokārt iegūst, kausējot dabiskās sēra iegulas tieši to atrašanās vietā — pazemē. Iegūst arī, rūpnieciski izkausējot no sēru saturošām rūdām. Sēru var iegūt arī no sēru saturošām gāzēm, kas rodas metalurģiskajā rūpniecībā (tādējādi turklāt tiek samazināts gaisa piesārņojums).
Fizikālās īpašības
[labot šo sadaļu | labot pirmkodu]Tīrā veidā sērs ir dzeltena kristāliska viela, kas sastāv no gredzenveida S8 molekulām. Stabilākā sēra modifikācija ir rombiskais sērs jeb α-sērs, daļēji stabils ir monoklīnais sērs jeb β-sērs, kura blīvums ir drusku mazāks un krāsa — gaišāka. Abu modifikāciju kristāli atšķiras ar gredzenveida molekulu savstarpējo novietojumu. Strauji atdzesējot sēra tvaikus uz aukstas virsmas, iegūst ļoti smalku pulveri, ko sauc par sēra ziediem. Lejot aukstā ūdenī verdošu sēra kausējumu, var iegūt plastisko sēru — tumšbrūnu, staipīgu gumijveida masu, kas sastāv no garām sēra atomu ķēdītēm (līdz vairākiem tūkstošiem atomu). Parastā temperatūrā plastiskais sērs ātri kļūst trausls un sabirst rombiskā sēra kristālos. Ir pazīstamas arī citas nestabilas sēra modifikācijas — veidotas no S2 molekulām (purpursarkanā krāsā) vai S6 molekulām (oranždzeltenā krāsā).
Karsējot sērs izkūst, veidojot laistīgu dzeltenu šķidrumu. Tālāk karsējot, apmēram 160 °C temperatūrā šķidrums sāk palikt tumšāks un sabiezē, bet pie 200 °C tas kļūst darvai līdzīgs — tumši brūns un viskozs. Tas izskaidrojams ar sēra ciklisko molekulu sairšanu un garu lineāru sēra atomu virkņu veidošanos. Turpinot karsēšanu, garās ķēdes sāk sairt un viskozitāte atkal samazinās, līdz kamēr sērs sāk vārīties. Sēra tvaikos, atkarībā no temperatūras, ir S8, S6, S4 vai S2 molekulas, ar ko izskaidrojama sēra tvaiku krāsas maiņa no oranždzeltenas līdz gaišdzeltenai. Interesanti, ka S2 molekulas ir paramagnētiskas — tās pievelk magnēts. 1500 °C temperatūrā sērs disociē atsevišķos atomos.
Sērs ūdenī praktiski nešķīst, bet dažas tā modifikācijas šķīst sērogleklī vai organiskos šķīdinātājos (toluolā). Sērs ir blīvāks par ūdeni, tādēļ tā gabaliņi ūdenī grimst. Tomēr sēra smalks pulveris peld ūdenī, jo ūdens sēru neslapina.
Sērs, tāpat kā citi nemetāli, slikti vada siltumu un nevada elektrisko strāvu.
Ķīmiskās īpašības
[labot šo sadaļu | labot pirmkodu]Atšķirībā no skābekļa, sēra veidotās atomu ķēdes ir pilnīgi stabilas. Tas veido zigzagveida atomu virknes, no kurām visstabilākās ir cikliskas vainaga veida molekulas no astoņiem atomiem.
Sēra elektronegativitāte ir samērā liela (tomēr daudz mazāka nekā skābeklim) un tas ir diezgan aktīvs — veido savienojumus ar gandrīz visiem elementiem. Sērs parasti ir oksidētājs. Kā reducētājs sērs reaģē ar skābekli un halogēniem, kas ir elektronegatīvāki. Sērs mēdz būt divvērtīgs, četrvērtīgs vai sešvērtīgs. Savienojumos sēram var būt oksidēšanas pakāpe -2 (sulfīdos), +4 (SO2 un sulfītos) vai +6 (sērskābē un sulfātos). Retāk sastopama oksidēšanas pakāpe +2, piemēram, sēra halogenīdos.

Istabas temperatūrā sērs reaģē kā reducētājs ar fluoru, hloru un koncentrētām oksidējošām skābēm (HNO3, H2SO4):
S + 3F2 → SF6
S + Cl2 → SCl2
S + 6HNO3 → H2SO4 + 6NO2 ↑ + 2H2O
S + 2H2SO4 → 3SO2 ↑ + 2H2O
Gaisā sērs deg, veidojot gāzi ar asu smaku — sēra dioksīdu:
S + O2 → SO2
Iedarbojoties ar metāliem, veido sulfīdus.
Karsējot reaģē ar oglekli, silīciju, fosforu, ūdeņradi:
C + 2S → CS2 (sērogleklis)
Sērs reaģē ar karstiem sārmiem, iesaistoties disproporcionēšanās reakcijā:
3S + 6KOH → K2SO3 + 2K2S + 3H2O
Sēra savienojumi
[labot šo sadaļu | labot pirmkodu]Sēru saturošās skābes
[labot šo sadaļu | labot pirmkodu]| H2SOn veida skābekli saturošās skābes | ||||
|---|---|---|---|---|
| Sēra vidējā oksidēšanas pakāpe |
Uzbūve | Skābes | Sāļi | Piemēri un piezīmes |
| +2 | Sulfoksilskābe H2SO2 |
Sulfoksilāti | ||
| +4 | Sērpaskābe H2SO3 |
Sulfīti | ||
| +6 |  |
Sērskābe H2SO4 |
Sulfāti | |
| +6 |  |
Peroksisērskābe (Karo skābe) H2SO5 |
Peroksisulfāti |
|
| H2S2On veida skābekli saturošās skābes | ||||
|---|---|---|---|---|
| Sēra vidējā oksidēšanas pakāpe |
Uzbūve | Skābes | Sāļi | Piemēri un piezīmes |
| +1 | Tiosērpaskābe H2S2O2 |
Tiosulfīti (nav pazīstami) |
||
| -2 un +6 |  |
Tiosērskābe H2S2O3 |
Tiosulfāti |
|
| +3 | Ditiosērpaskābe H2S2O4 |
Ditionīti |
| |
| +4 |  |
Disērpaskābe H2S2O5 |
Disulfīti |
|
| +5 |  |
Ditionskābe H2S2O6 |
Ditionāti |
|
| +6 |  |
Disērskābe H2S2O7 |
Disulfāti | |
| +6 |  |
Peroksidisērskābe H2S2O8 |
Peroksidisulfāti |
|
Citi sēra savienojumi
[labot šo sadaļu | labot pirmkodu]- Sērogleklis CS2, normālos apstākļos ir šķidrums, dažreiz lieto par šķīdinātāju.
- Sēra heksafluorīds (elegāze) SF6, normālos apstākļos ir gāze, lieto par elektroizolācijas materiālu augstsprieguma slēdžos.
Izmantošana
[labot šo sadaļu | labot pirmkodu]
Sēru lieto sērskābes ražošanai, kaučuka vulkanizācijai, sērkociņu ražošanai, kā fungicīdu lauksaimniecībā. Koloīdo sēru izmanto medicīnā (dažādās ziedēs).
Atsauces
[labot šo sadaļu | labot pirmkodu]- ↑ N.Ahmetovs. Neorganiskā ķīmija, Rīga, "Zvaigzne", 1978
Ārējās saites
[labot šo sadaļu | labot pirmkodu] Vikikrātuvē par šo tēmu ir pieejami multivides faili. Skatīt: Sērs.
Vikikrātuvē par šo tēmu ir pieejami multivides faili. Skatīt: Sērs.
- Latvijas Nacionālās enciklopēdijas šķirklis
- Encyclopædia Britannica raksts (angliski)
- Brockhaus Enzyklopädie raksts (vāciski)
- Krievijas Lielās enciklopēdijas raksts (krieviski)
- Encyclopædia Universalis raksts (franciski)
- Enciklopēdijas Krugosvet raksts (krieviski)
| H | He | ||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | As | Br | Kr | ||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Te | I | Xe | |||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Rn | ||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Sārmu metāli | Sārmzemju metāli | Lantanīdi | Aktinīdi | Pārejas metāli | Citi metāli | Pusmetāli | Citi nemetāli | Halogēni | Cēlgāzes |
|








