Ogleklis
| Ogleklis | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
 Ogles pulveris | |||||||
| Oksidēšanas pakāpes |
+4, +3, +2, +1, 0, −1, −2, −3, −4 (organiskos savienojumos parasti daļskaitlis) | ||||||
| Elektronegativitāte | 2,55 | ||||||
| Blīvums | 2267 kg/m3 (grafīts), 3516 - 3525 kg/m3 (dimants) kg/m3 | ||||||
| Kušanas temperatūra | Trīskāršais punkts pie 10 MPa un (4300 - 4700) K | ||||||
| Viršanas temperatūra | Sublimējas pie ≈4000 K | ||||||
Ogleklis ir ķīmiskais elements ar simbolu C un atomskaitli 6. Ogleklis ietilpst visu organisko vielu sastāvā. Ogleklim ir divas stabilas alotropiskās formas: grafīts un dimants. Dimants ir viena no viscietākajām pazīstamajām vielām. Savukārt grafīts ir viens no mīkstākajiem minerāliem, un to lieto kā dažu smērvielu sastāvdaļu. Ogleklis ir viena no grūtāk kūstošajām vielām (grafīta formā), gaisā grafītu var karsēt līdz ≈900oC, bet skābekli nesaturošā atmosfērā grafīta bāzētos ugunsturīgos materiālus var lietot līdz ≈3000oC. Savienojumos ogleklis parasti ir ar vērtību -4 (metāns), +2 (oglekļa monoksīds) un +4 (oglekļa dioksīds, karbonāti).
Oglekļa atrašanās dabā
[labot šo sadaļu | labot pirmkodu]Pēc izplatības Zemes garozā ogleklis ieņem 17. vietu, kas ir aptuveni 0,48% no visas zemes virsmas masas. Dabā pastāv divi oglekļa alotropiskie veidi — grafīts un dimants. Savienojumu veidā ogleklis atrodas visās augu un dzīvnieku valsts vielās — organiskajās vielās, kā arī oglekļa dioksīdā un minerālos — krītā, kaļķakmenī, marmorā, dolomītā un citur. Dabā ogleklis sastopams divu stabilu izotopu 12C (98,892%) un 13C (1,108%) veidā.
Oglekļa alotropiskie veidi
[labot šo sadaļu | labot pirmkodu]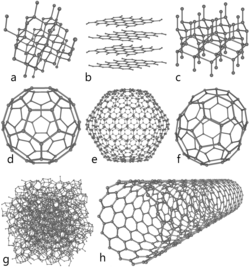
Ogleklim ir trīs alotropiskie veidi — grafīts, dimants un karbīns. Amorfais ogleklis jeb ogle ir grafīta paveids.
Grafīta atradnes ir Altajā, Austrumsibīrijā, Ukrainā, Meksikā, Kalifornijā, Viduseiropā, Madagaskarā, Šrilankā, Dienvidkorejā.
Dimanti dabā sastopami reti. Tie atrodami sanesuma iežos Jakutijā, Dienvidāfrikā, Dienvidamerikā, Austrālijā, Indijā. Ļoti liels dimanta tīrradnis "Kullināns" atrasts Dienvidāfrikā 1905. gadā, tā masa ir 3106 karāti (1 karāts = 0,2 grami).
Grafīts
[labot šo sadaļu | labot pirmkodu]
Grafīts ir tumšpelēka, kristāliska viela ar metālisku spīdumu. Tas deg tikai tīrā skābeklī.
Grafītam ir slāņaina heksagonāla struktūra, kas atbilst elektronu orbitāļu sp2 hibridizācijai. Oglekļa atomu sešlocekļu gredzenu slāņi ir vājāk saistīti viens ar otru. Tāpēc grafīts ir mīksts un sadalās pelēkos zvīņveida slāņos. Tie līp pie papīra, tāpēc grafītu lieto zīmuļu izgatavošanai.
Grafītam piemīt augsta elektrovadītspēja. No tā ražo elektrodus. Grafītu vēl izmanto ziežvielu, ugunsizturīgu materiālu un krāsvielu ražošanai, kā arī par neitronu palēninātāju kodoltehnikā.
Amorfais ogleklis
[labot šo sadaļu | labot pirmkodu]Amorfais ogleklis jeb ogle nav īpaša oglekļa modifikācija. Tā ir melna, cieta viela, kas sastāv no sīkiem, neregulāras struktūras grafīta kristāliņiem. Amorfa oglekļa blīvums ir no 1,8 līdz 2,1 g/cm3.
Amorfo oglekli (ogli) iegūst, termiski sadalot organiskos savienojumus. Nozīmīgākie ogles veidi ir kokss, kokogle, kaulu ogle un kvēpi. Kvēpi ir tīrākais amorfais ogleklis. Tie rodas, termiski sadalot vai nepietiekamā gaisa daudzumā sadedzinot ar oglekli bagātas vielas (dabasgāzi, sveķus, terpentīnu). Koksu izmanto ķīmiskajā rūpniecībā un metalurģijā par reducētāju un kurināmo. Kvēpus lieto par pildvielu gumijas un plastmasu izstrādājumos, par melno pigmentu krāsvielās un tušā. Amorfo oglekli apstrādājot ar pārkarsētu ūdens tvaiku, iegūst aktīvo ogli, kuru lieto par adsorbentu dažādu vielu attīrīšanai ķīmiskajā un pārtikas rūpniecībā, medicīnā (karbolēna tabletes), gāzmaskās.
Dimants
[labot šo sadaļu | labot pirmkodu]
Dimants ir bezkrāsaina, caurspīdīga, kristāliska viela, kas stipri lauž gaismas starus. Nereti tas ir zilgans, iedzeltens, sārts, tumšpelēks, pat melns. Ja dimantu sakarsē līdz 850 °C temperatūrai, skābekļa atmosfērā tas sadeg. 1772. gadā A. Lavuazjē konstatēja, ka, sadegot dimantam, rodas tikai oglekļa dioksīds.
Dimantam ir tetraedriska struktūra. Tajā katrs oglekļa atoms ir saistīts ar četriem kaimiņatomiem. Šīs saites ir vienāda garuma un cita ar citu veido 109°28' lielus leņķus. Tāpēc dimantam piemīt ārkārtīgi liela cietība, taču tas ir trausls. Dimants slikti vada elektrību un siltumu. Tā blīvums ir 3,52 g/cm3.
Ja dimantu stipri karsē bez gaisa piekļuves 1000 °C temperatūrā, tas pārvēršas grafītā.
Speciāli slīpētus dimantus sauc par briljantiem. Tos lieto juvelierizstrādājumu izgatavošanai. Dimantu tā lielās cietības dēļ lieto cietu materiālu apstrādei, iežu urbšanai. Pieprasījums pēc tehnikā izmantojamiem dimantiem ir liels, tāpēc augstā temperatūrā un spiedienā tos mākslīgi iegūst no grafīta.
Karbīns
[labot šo sadaļu | labot pirmkodu]Karbīns ir melna, pulverveida viela, kuru ieguva 1963. gadā, katalītiski oksidējot acetilēnu. Tam ir heksagonāls kristālrežģis, ko veido lineāras oglekļa atomu ķēdes ar šādu saišu izvietojumu:
Ķīmiskās īpašības
[labot šo sadaļu | labot pirmkodu]Parastajos apstākļos ogleklis ir ķīmiski inerts. Augstākās temperatūrās tā aktivitāte pieaug. Vislielākā reaģētspēja piemīt amorfajam ogleklim, mazāk aktīvs ir grafīts, bet dimantam ir viszemākā ķīmiskā aktivitāte. Ogleklis ir labs reducētājs, bet tā oksidējošās īpašības izpaužas vājāk.
- Parastajos apstākļos ogleklis (amorfa oglekļa veidā) reaģē tikai ar fluoru:
- C + 2F2 → CF4
Grafīta reakcija ar fluoru sākas aptuveni 900 °C temperatūrā, bet dimants ar fluoru nereaģē. Ar pārējiem halogēniem ogleklis tieši nesavienojas.
- Sakarsēts ogleklis (ogle aptuveni 400 °C, grafīts aptuveni 700 °C, dimants aptuveni 1000 °C) gaisā aizdegas un veido oglekļa(IV) oksīdu (oglekļa dioksīdu) vai oglekļa(II) oksīdu (oglekļa monoksīdu):
- C + O2 → CO2 (skābekļa pārākumā)
- 2C + O2 → 2CO (nepietiekamā skābekļa daudzumā)
- Ja slāpekļa atmosfērā ievieto ogles vai grafīta elektrodus, starp kuriem rada Voltas loku (aptuveni 4000 °C), tad veidojas oglekļa nitrīds jeb diciāns:
- 2C + N2 → C2N2
- Ogleklis ir nemetāls, taču ar metāliem tas savienojas tikai augstā temperatūrā, veidojot karbīdus:
- 4Al + 3C → Al4C3
- 3Fe + C → Fe3C
Oglekļa reakcijās ar saliktām vielām izpaužas tā reducējošās īpašības, kuras izmanto galvenokārt metālu iegūšanai no to oksīdiem (karbotermija). Faktiskais reducētājs karbotermijā ir oglekļa(II) oksīds CO.
Sakarsēts kokss vai kokogle reaģē arī ar oglekļa(IV) oksīdu un ūdens tvaiku. Šīs reakcijas izmanto gāzveida kurināmā ražošanai.
Oglekļa savienojumi
[labot šo sadaļu | labot pirmkodu]Oglekļa(II) savienojumi
[labot šo sadaļu | labot pirmkodu]Oglekļa(II) oksīdu jeb oglekļa monoksīdu CO ikdienā sauc arī par tvana gāzi. CO molekulā starp oglekļa un skābekļa atomiem ir trīs kovalentās saites, no kurām viena veidojas pēc donorakceptora mehānisma: skābekļa atoma viens nedalītais elektronu pāris pāriet oglekļa atoma brīvajā p orbitālē. Tādēļ ķīmiskā saite oglekļa monoksīda molekulā uzskatāma par trīskāršo saiti.
CO molekulā gan ogleklis, gan skābeklis ir divvērtīgs, bet to oksidēšanas pakāpe ir attiecīgi +2 un -2.
Oglekļa(II) oksīds rodas, ja caur degošu ogles slāni gaiss plūst nepietiekamā daudzumā. Vispirms veidojas oglekļa(IV) oksīds. Kvēlojošās ogles to reducē par CO:
- C + O2 → CO2 (skābekļa pārākumā)
- 2C + O2 → 2CO (nepietiekamā skābekļa daudzumā)
Tā rodas tvana gāze krāsnīs, un tā arī iegūst gāzveida kurināmo gāzģeneratoros un reducētāju CO karbotermijai. Oglekļa(II) oksīds veidojas, nepilnīgi sadegot šķidrajai degvielai — benzīnam, solāreļļai, petrolejai, tāpēc iekšdedzes dzinēju izplūdes gāzēs CO tilpumdaļa ir 2... 10%. Laboratorijā CO iegūst, pilinot skudrskābi līdz 80 °C sakarsētā koncentrētā sērskābē (sērskābe vienkārši atņem ūdeni):
- HCOOH + H2SO4 → H2SO42 H2O + CO
CO ir bezkrāsaina gāze bez smakas. Tā ir nedaudz vieglāka par gaisu, slikti šķīst ūdeni, labi — etanolā un benzolā. Oglekļa(II) oksīdam ir zema viršanas temperatūra (-191,5 °C). Oglekļa(II) oksīds CO ir ļoti indīgs! Tā pieļaujamā koncentrācija gaisā ir 30 mg/m3. CO ir sāļus neradošs oksīds. Tam raksturīgas savienošanas reakcijas. Tā, piemēram, CO deg gaisā un skābekli, izdalot lielu siltuma daudzumu:
- 2CO + O2 → 2CO2 + 565,93 kJ
Saules gaismā vai aktīvās ogles klātbūtnē CO savienojas ar hloru, veidojot indīgu gāzi - fosgēnu:
- CO + Cl2 → COCl2
CO savienojas ar daudziem metāliem, veidojot metālu karbonilus:
- 4CO + Ni → [Ni(CO)4]
CO ir spēcīgs reducētājs:
- Fe2O3 + 3CO → 2Fe + 3CO2
CO lieto par reducētāju metalurģijā, par gāzveida kurināmo, par vērtīgu izejvielu neorganiskajā un organiskajā sintēzē.
Oglekļa(IV) savienojumi
[labot šo sadaļu | labot pirmkodu]Oglekļa(IV) oksīds (oglekļa dioksīds, ogļskābā gāze) CO2 ir savienojums ar četrām polārām kovalentām saitēm, taču pati CO2 molekula ir lineāra un simetriska, tādēļ nepolāra:
O = C = O
CO2 tilpumdaļa gaisā ir aptuveni 0,03%. Tā kopējā masa Zemes atmosfērā ir aptuveni 4,5·1013 tonnas.
Oglekļa(IV) oksīds nav indīgs, bet tam ir slāpējošas īpašības. Tāpēc telpas, kurās uzturas daudz cilvēku, bieži jāvēdina. Ja CO2 tilpumdaļa gaisā palielinās līdz 3%, strauji pasliktinās pašsajūta, bet, ja ieelpojamais gaiss satur 10% CO2, iestājas bezsamaņa un nāve. Oglekļa(IV) oksīdu satur arī okeāna un iekšzemes ūdeņi. Minerālūdeņos tā koncentrācija var sasniegt 1,5 g/l.
CO2 dabā veidojas dažādos oksidēšanas procesos — elpošanā, pūšanā, degšanā, lielos daudzumos tas izdalās no vulkāniem.
Rūpniecībā CO2 iegūst spirta rūgšanas procesā, kā arī termiski sadalot kaļķakmeni un dolomītu. Laboratorijā to iegūst, iedarbojoties uz marmoru vai citiem karbonātiem ar sālsskābi:
- 2HCl + CaCO3 → CaCl2 + H2CO3 (ogļskābe tūlīt sadalās par ūdeni un CO2)
Oglekļa(IV) oksīds ir bezkrāsaina gāze bez smakas. Tas ir 1,5 reizes smagāks par gaisu, labi šķīst ūdenī (87,8 cm3/100 g H2O 20 °C). Ja normālā spiedienā CO2 pakāpeniski atdzesē, tas nepārvēršas šķidrumā, bet -78,52 °C temperatūrā kristalizējas, veidojot sniegveida masu — "sauso ledu", kuram ir molekulu kristālrežģa struktūra. CO2 var sašķidrināt tikai paaugstinātā spiedienā (5,73 MPa 20 °C temperatūrā). CO2 ir skābais oksīds, kam, šķīstot ūdenī, veidojas nedaudz ogļskābes (process ir apgriezenisks):
- CO2 + H2O ⇄ H2CO3
20 °C temperatūrā ogļskābē pārvēršas aptuveni 1% no ūdenī izšķīdušā CO2 tilpuma. CO2 reaģē ar bāziskajiem oksīdiem un ar sārmiem. Tāpēc arī dzēstie un dedzinātie kaļķi (Ca(OH)2, CaO) gaisā pārvēršas par kalcija karbonātu. CO2 iedarbību uz kaļķūdeni izmanto šīs gāzes pierādīšanai:
- CO2 + Ca(OH)2 → CaCO3 + H2O
Paaugstinātā spiedienā CO2 reaģē ar amonjaku NH3, veidojot karbamīdu:
- CO2 + 2NH3 → CO(NH2)2 + H2O
Spēcīgu reducētāju ietekmē CO2 pilnīgi vai daļēji zaudē skābekli.
CO2 izmanto sodas, cukura, karbamīda, organisko skābju ražošanā, gāzētā ūdens pagatavošanai. To lieto ugunsdzēsībā, dažādās sintēzēs inertas atmosfēras radīšanai, lāzertehnikā. "Sauso ledu" izmanto zemas temperatūras uzturēšanai.
Oglekļa(IV) oksīdam ir izšķiroša nozīme fotosintēzē un ūdens cietības veidošanās procesā. Ogļskābe H2CO3 rodas, šķīdinot CO2 ūdenī. Tā ir nestabila un ļoti vāja skābe, jo iegūtajā šķīdumā iestājas ķīmiskais līdzsvars, kas stipri novirzīts pa kreisi.
H2CO3 disociē galvenokārt H+ un HCO3− jonos, bet CO32− jonu veidojas nedaudz.
Skatīt arī
[labot šo sadaļu | labot pirmkodu]Ārējās saites
[labot šo sadaļu | labot pirmkodu] Vikikrātuvē par šo tēmu ir pieejami multivides faili. Skatīt: Ogleklis.
Vikikrātuvē par šo tēmu ir pieejami multivides faili. Skatīt: Ogleklis.
- Latvijas Nacionālās enciklopēdijas šķirklis
- Encyclopædia Britannica raksts (angliski)
- Brockhaus Enzyklopädie raksts (vāciski)
- Krievijas Lielās enciklopēdijas raksts (krieviski)
- Encyclopædia Universalis raksts (franciski)
- Enciklopēdijas Krugosvet raksts (krieviski)
| H | He | ||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | As | Br | Kr | ||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Te | I | Xe | |||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Rn | ||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Sārmu metāli | Sārmzemju metāli | Lantanīdi | Aktinīdi | Pārejas metāli | Citi metāli | Pusmetāli | Citi nemetāli | Halogēni | Cēlgāzes |
|




